

CASO CLÍNICO | Respirar, 2025; 17(3): 356–365 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.17.3.14
Ashok P Arbat
https://orcid.org/0000-0002-8694-2597
Diti Gandhasiri
https://orcid.org/0000-0001-8257-3205
Sweta R Chourasia
https://orcid.org/0000-0001-7204-8546
Swapnil I Bakamwar
https://orcid.org/0000-0002-1143-0319
Parimal S Deshpande
https://orcid.org/0000-0002-3391-703X
Recibido:
11 junio 2025
Aprobado:
4 julio 2025
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
La fiebre como primer hallazgo:
un caso atípico de tumor marrón oculto
Fever as the First Clue: an Atypical Case of Occult Brown Tumor
Ashok P. Arbat , Diti V. Gandhasiri
, Diti V. Gandhasiri , Sweta R. Chourasia
, Sweta R. Chourasia ,
,
Swapnil I. Bakamwar , Parimal S. Deshpande
, Parimal S. Deshpande
Ketki Research Institute of Medical Sciences, Pulmonary Department, Nagpur, Maharashtra, India.
Autor CORRESPONSAL:
Ashok P Arbat, ashok_arbat@yahoo.com
Resumen
Un hombre asiático de 46 años presentó dolor de garganta, ronquera, tos seca y fiebre alta persistente que no respondía a antibióticos. Las imágenes mostraron consolidación del lóbulo superior izquierdo y la broncoscopia no reveló causa infecciosa. Aunque el paciente mejoró inicialmente con antibióticos intravenosos, la fiebre reapareció tras el alta, lo que requirió una evaluación adicional. Las imágenes identificaron múltiples lesiones óseas líticas, inicialmente sugestivas de malignidad. Sin embargo, la biopsia ósea reveló osteítis fibrosa quística (tumor marrón), indicativa de enfermedad ósea metabólica. Las pruebas de laboratorio mostraron niveles marcadamente elevados de hormona paratiroidea (PTH) con niveles séricos altos-normales de calcio, lo que confirmó hiperparatiroidismo primario. La PET-CT y la gammagrafía paratiroidea localizaron un adenoma paratiroideo inferior izquierdo. La resección quirúrgica del adenoma condujo a la normalización de los niveles de PTH y a la resolución de los síntomas sistémicos, incluyendo la fiebre. Este caso resalta la fiebre como una presentación atípica del hiperparatiroidismo primario y subraya la importancia de considerar trastornos endocrinos en casos de pirexia de origen desconocido, especialmente cuando se excluyen causas infecciosas y malignas convencionales.
Palabras clave: tumor pardo, fiebre, hiperparatiroidismo, hormona paratiroidea (PTH), osteítis fibrosa quística, neumonía.
Abstract
A 46-year-old asian male presented with throat pain, hoarseness, dry cough and persistent high-grade fever unresponsive to antibiotics. Imaging showed left upper lobe consolidation and bronchoscopy revealed no infectious cause. Although the patient initially improved with intravenous antibiotics, fever recurred post-discharge, prompting further evaluation. Imaging identified multiple lytic bone lesions, initially suggestive of malignancy. However, bone biopsy revealed osteitis fibrosa cystica (Brown tumor), indicating metabolic bone disease. Laboratory tests showed markedly elevated parathyroid hormone (PTH) levels with high-normal serum calcium, confirming primary hyperparathyroidism. PET-CT and parathyroid scintigraphy localized a left inferior parathyroid adenoma. Surgical resection of the adenoma led to normalization of PTH levels and resolution of systemic symptoms, including fever. This case highlights fever as an atypical presentation of primary hyperparathyroidism and underscores the importance of considering endocrine disorders in cases of pyrexia of unknown origin, especially when conventional infectious and malignant causes are excluded.
Keywords: brown tumor, fever, hyperparathyroidism, parathyroid hormone (PTH), osteitis fibrosa cystica, pneumonia.
Los tumores marrones (TM) son lesiones óseas raras que ocurren en aproximadamente el 0,1% de las personas, con mayor frecuencia en mujeres mayores de 50 años con hiperparatiroidismo mal controlado.1 El exceso de hormona paratiroidea (PTH) aumenta la actividad osteoclástica, lo que conduce a la resorción ósea, desmineralización, microfracturas, hemorragia y acumulación de tejido fibroso y células gigantes. Estos cambios forman lesiones similares a tumores. Aunque pueden desarrollarse en cualquier hueso, los TM se encuentran con mayor frecuencia en las costillas, clavículas, huesos largos de las extremidades y pelvis.2
La evaluación diagnóstica de los TM incluye mediciones séricas de calcio, fósforo y PTH, seguidas de estudios por imágenes como radiografías y tomografías computarizadas (TC) para detectar lesiones óseas líticas. La gammagrafía paratiroidea (99mTc-sestamibi) ayuda a localizar glándulas paratiroides hiperactivas o agrandadas, mientras que la gammagrafía ósea, cuando se realiza, muestra captación aumentada en las áreas afectadas. La histopatología es esencial para la confirmación, pero sus hallazgos—células mononucleares mezcladas con células gigantes multinucleadas—también se observan en tumores de células gigantes, lo que puede llevar a diagnósticos erróneos. Las características por imagen pueden imitar otras lesiones osteolíticas como mieloma múltiple o metástasis líticas.3-6 Por lo tanto, identificar un hiperparatiroidismo subyacente es clave. Aunque los niveles elevados de PTH son característicos de esta condición, no se miden de forma rutinaria, lo que hace que el diagnóstico de los TM sea especialmente desafiante para los médicos.3,7
Los TM suelen causar dolor óseo, hinchazón o fracturas patológicas. Los síntomas atípicos incluyen compresión nerviosa, compromiso medular o hallazgos incidentales en estudios por imágenes en sitios poco comunes.8 Este reporte de caso describe a un hombre de mediana edad con fiebre de origen desconocido que inicialmente se pensó que tenía neumonía infecciosa, pero que luego fue diagnosticado con un TM.
Informe de caso
Un hombre asiático de 46 años (índice de masa corporal: 24,34) se presentó con dolor de garganta, disfonía, tos seca y fiebre intermitente de alta intensidad durante ocho días, sin respuesta a una semana de antibióticos empíricos orales. Los signos vitales eran normales. El examen respiratorio reveló rales crepitantes en el lado izquierdo, el resto del examen físico fue normal. Las pruebas serológicas mostraron una velocidad de sedimentación globular elevada de 44 mm/h y una proteína C reactiva (PCR) de 15,67 mg/L. Las pruebas de función hepática revelaron una fosfatasa alcalina (FA) elevada de 498,19 U/L. Véase la Tabla 1 para análisis de laboratorio detallado.
El paciente fue ingresado para evaluar la fiebre persistente. Una tomografía computarizada (TC) del tórax reveló consolidación del lóbulo superior izquierdo (segmento lingular superior), sugerente de neumonitis bacteriana aguda (Figura 1a). Se hizo un diagnóstico presuntivo de neumonía bacteriana y la broncoscopia mostró secreciones espesas en el árbol bronquial izquierdo. El lavado broncoalveolar (LBA) se envió para bacilos ácido-alcohol resistentes (BAAR), tinciones de Gram y hongos, así como cultivos bacterianos y micóticos, además de prueba GeneXpert—todos los cuales resultaron negativos (Tabla 1). Se administraron antibióticos intravenosos empíricos durante cinco días. El paciente mejoró sintomáticamente, dejó de tener fiebre y fue dado de alta.
Tabla 1.
Investigaciones de laboratorio de rutina
|
Investigaciones de laboratorio |
Resultados |
Rango normal |
|
Primera admisión |
||
|
Anticuerpos VIH I&II |
No reactivo |
|
|
Anti VHC-Total |
No reactivo |
|
|
Antígeno australiano (HBsAg) |
Negativo |
|
|
Recuento sanguíneo completo |
DLN |
|
|
Proteína C reactiva (PCR) |
15,67 mg/L |
≤ 5 |
|
VSG (Wintrobe) |
44 mm/1 h. 45 (26/3/25) |
0-9 |
|
Fosfatasa alcalina |
498,19 U/L |
54-369 |
|
Tifus de los Matorrales (IgG & IgM) |
Negativo |
|
|
Análisis de orina |
DLN |
|
|
BAL para |
||
|
Tinción de Gram (aspirado bronquial) |
No se observaron organismos |
|
|
Examen de frotis BAAR |
No se observaron bacilos acidorresistentes |
|
|
Tinción fúngica (aspirado bronquial) |
No se observaron elementos fúngicos |
|
|
Ensayo GeneXpert MTB/RIF |
No se detectó MTb |
|
|
Cultivo bacteriano |
No se observó crecimiento |
|
|
Citopatología |
Negativo para malignidad |
|
|
Segunda admisión |
||
|
CSC |
DLN |
|
|
PCR |
31,35 mg/L |
≤ 5 |
|
Procalcitonina |
0,13 ng/ml |
< 0,5 |
|
Análisis de orina rutinario |
DLN |
|
|
Prueba de detección de antígeno de la malaria (Vivax y Falciparum) |
Negativo |
|
|
Prueba de Widal en portaobjetos |
Sin aglutinación |
|
|
IgG e IgM de tifus de los matorrales |
Negativo |
|
|
Anti-CCP |
< 3,5 U/ml |
0-5 |
|
Pruebas preoperatorias |
||
|
TSH (ultrasensible) |
3,24 µlU/ml |
0,35-5,0 µlU/ml |
|
T3 libre |
2,39 |
1,71 – 3,71 pg/ml |
|
Tiroxina libre (FT4) T4 libre |
0,79 ng/ml |
0,7 – 1,48 ng/ml |
|
PTH |
916,6 pg/ml |
14-72 pg/ml |
|
Calcio sérico |
10,16 mg/dL |
8,5-10,5 mg/dL |
|
Fósforo sérico |
2,56 mmol/L |
2,5-6,4 |
|
Prueba de 25-hidroxivitamina D (25(OH)D) |
12,10 ng/ml |
Deficiencia: < 10 |
|
Insuficiencia:10-30 |
||
|
Suficiencia:30-100 |
||
|
Hipervitaminosis: > 100 |
||
|
Pruebas postoperatorias |
||
|
PTH |
7,00 |
< 1 month: 7,0 - 59 pg/ml |
|
Calcio sérico |
8,02 mg/dL |
8,5-10,5 mg/dL |
Abreviaturas: VIH-virus de la inmunodeficiencia humana; VHC-virus de la hepatitis C; CSC-hemograma completo; PCR-proteína C reactiva; VSG-velocidad de sedimentación globular; IgG-inmunoglobulina G; IgM-inmunoglobulina M; BAL-lavado broncoalveolar; AFB-bacilo ácido alcohol resistente; MTB/RIF-Mycobacterium tuberculosis/rifampicina; Anti-CCP-antipéptido citrulinado cíclico; TSH-hormona estimulante del tiroides; T3-triyodotironina; PTH-hormona paratiroidea; DLN- dentro de límites normales
Figura 1.
Figura 1a. La tomografía computarizada (TC) del tórax revela una consolidación densa en el espacio aéreo con broncograma aéreo que afecta el segmento lingular superior del lóbulo superior izquierdo, sugestiva de neumonitis bacteriana aguda.
Figura 1b. TC del tórax repetida durante la readmisión que muestra una leve resolución en el tamaño de la consolidación.
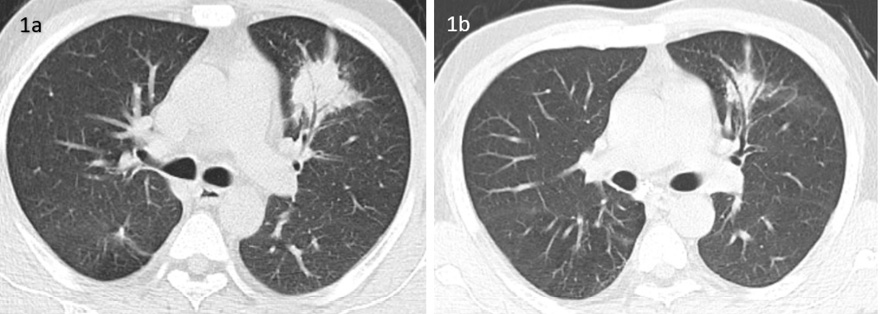
Un día después del alta, el paciente desarrolló fiebre alta y fue reingresado. Se inició una evaluación exhaustiva para fiebre de origen desconocido (FOD). Las investigaciones, incluyendo hemograma, análisis y cultivo de orina, prueba de Widal, frotis periférico para parásitos de malaria, antígeno NS1 para dengue, procalcitonina, anti-CCP e IgG/IgM para tifus de los matorrales, fueron todas negativas. Sin embargo, la PCR se elevó a 31,35 mg/L (Tabla 1). Una nueva TC de tórax mostró leve resolución de la consolidación (Figura 1b). Una ecografía abdominal reveló una gran lesión heterogénea en el lóbulo izquierdo del hígado, con áreas hiperecogénicas sugestivas de una lesión ocupante de espacio benigna con hemorragia intralesional o absceso en etapa temprana.
La TC abdominal con contraste confirmó que las lesiones hepáticas eran hemangiomas. Sin embargo, la presencia de múltiples lesiones líticas bien definidas en los huesos pélvicos y vértebras lumbares justificó realizar una biopsia para descartar metástasis óseas. También se encontraron colelitiasis, litiasis renal bilateral no obstructiva y quistes renales simples.
Se realizó una biopsia ósea guiada por TC del hueso ilíaco izquierdo utilizando una aguja Jamshidi. La muestra fue enviada para evaluación histopatológica y citológica. La citología mostró células ovaladas a fusiformes dentro de hebras fibrosas, con leve atipia y sin malignidad. La histopatología reveló numerosas células gigantes tipo osteoclasto en un estroma de células fusiformes fibroblásticas—características consistentes con osteítis fibrosa quística (TM) del hueso ilíaco (Figura 2).
Se realizó una tomografía por emisión de positrones con 18F-FDG (PET/TC). Las imágenes de cabeza y cuello revelaron una glándula paratiroides izquierda aumentada de tamaño, posterior e inferior al lóbulo tiroideo izquierdo, de 15×16 mm (SUV máx. <1). En el tórax, se observó una consolidación en el lóbulo superior izquierdo de 19×10 mm (SUV máx. 1,5), con ganglios linfáticos mediastinales calcificados. En el sistema musculoesquelético, se halló una lesión lítica en la espina ilíaca posterosuperior izquierda (SUV máx. 7,8) y múltiples lesiones permeativas vertebrales lumbares. No se detectaron otras lesiones metabólicamente activas (Figura 3).
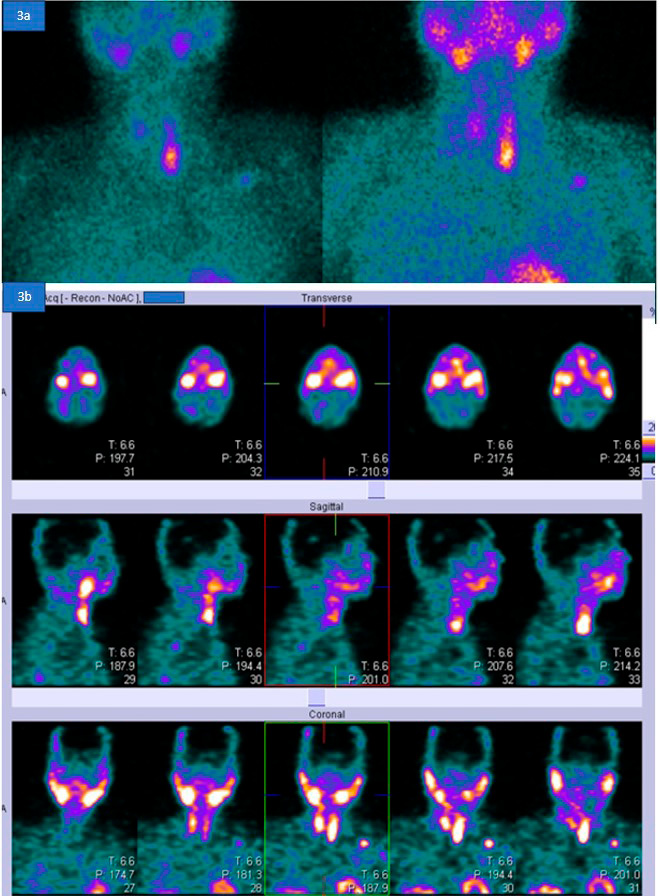
La ecografía del cuello mostró una lesión nodular bien definida iso- a hipoecoica adyacente al polo inferior del lóbulo tiroideo izquierdo, probablemente un adenoma paratiroideo benigno. La gammagrafía paratiroidea y la SPECT- TC mostraron captación anormal del trazador en un nódulo hipodenso debajo del lóbulo tiroideo izquierdo, de 1,8 × 1,4 × 2,5 cm, consistente con un adenoma paratiroideo (Figura 4).
Figura 2.
El análisis histopatológico de la muestra de biopsia mostró numerosas células gigantes dispersas tipo osteoclasto dentro de un estroma de células fusiformes fibroblásticas. Se observan pequeños vasos con glóbulos rojos en su interior. Estas características son consistentes con un tumor marrón del hueso ilíaco
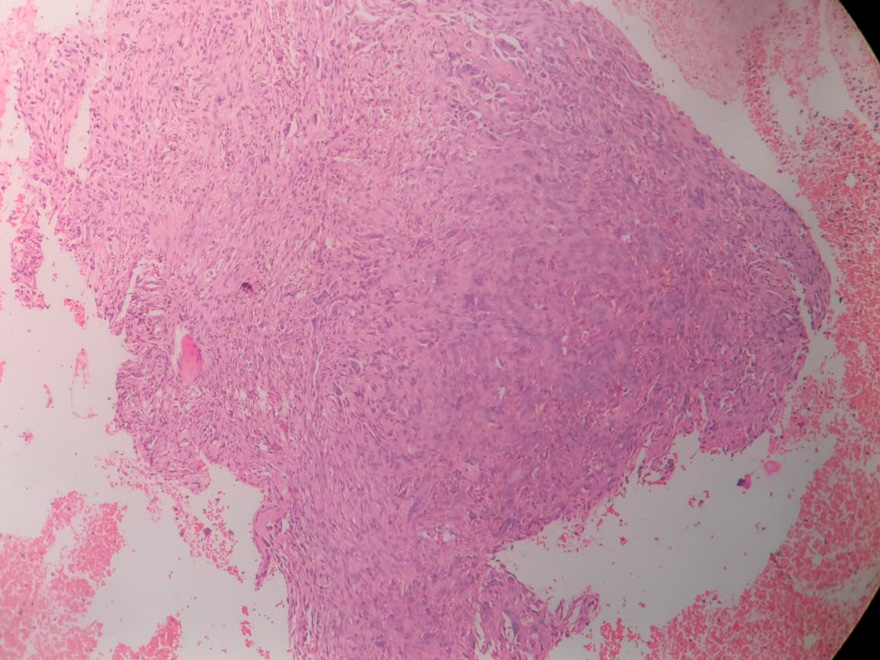
Figura 3.
Una tomografía por emisión de positrones (PET/TC) con 18F-FDG que muestra una lesión lítica en la espina ilíaca posterosuperior izquierda con un SUV máximo de 7,8.
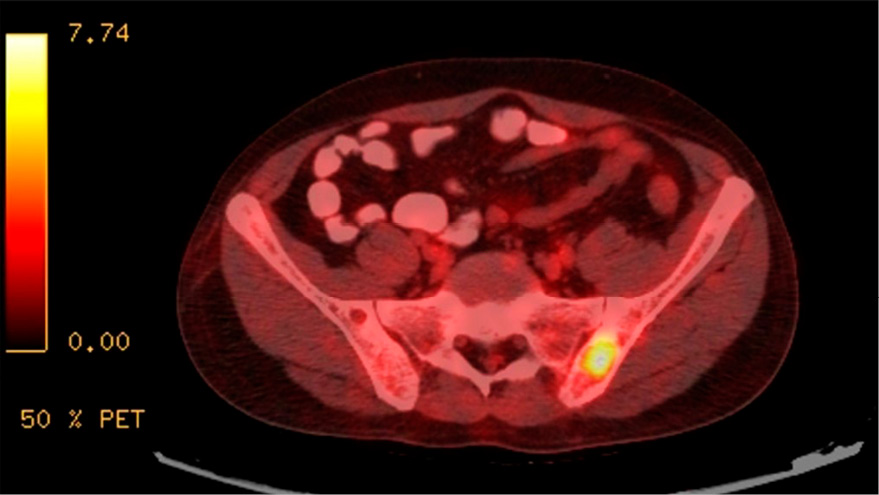
Figura 4.
Figura 4a. La gammagrafía paratiroidea con 12 mCi de Tc-99m tetrofosmina, incluyendo imágenes tempranas y tardías, revela una captación focal aumentada del trazador inferior al lóbulo tiroideo izquierdo. Se observa una captación difusa de bajo grado en el resto de la glándula tiroides, con un aclaramiento muy lento del trazador y una retención focal del mismo inferior al lóbulo tiroideo izquierdo.
Figura 4b. SPECT-TC que muestra una captación anormal del trazador en un nódulo hipodenso debajo del lóbulo tiroideo izquierdo, midiendo 1,8 × 1,4 × 2,5 cm, consistente con un adenoma paratiroideo.
Se recomendó la extirpación quirúrgica del tumor y se solicitó una consulta con endocrinología. Los análisis preoperatorios mostraron fósforo, tirotrofina, T3 y T4 normales, pero niveles de PTH marcadamente elevados (916,6 pg/mL), vitamina D baja (12,10 ng/mL) y calcio sérico en el límite superior de lo normal (10,16 mg/dL). Tras el consentimiento informado, se resecó el adenoma paratiroideo inferior izquierdo bajo anestesia general. En el postoperatorio, el paciente desarrolló hipocalcemia, la cual fue corregida. Los niveles de PTH se normalizaron tras la cirugía y el paciente fue dado de alta en condición estable con seguimiento programado. Las investigaciones pre y postoperatorias se presentan en la Tabla 1.
Discusión
Los TM, también conocidos como osteítis fibrosa quística, son lesiones óseas benignas poco comunes. Con frecuencia se diagnostican erróneamente, lo que retrasa el tratamiento y genera una carga económica innecesaria para el paciente.9 Suelen presentarse con dolor óseo localizado, sensibilidad, hinchazón o masas palpables, especialmente cerca de la superficie.10,11 Los huesos frágiles pueden provocar fracturas patológicas y las lesiones avanzadas pueden causar deformidades.12 Los síntomas de hipercalcemia debidos al hiperparatiroidismo incluyen fatiga, estreñimiento, náuseas, litiasis renal, debilidad muscular y poliuria.13 Las manifestaciones atípicas incluyen déficits neurológicos por compresión nerviosa, asimetría facial, expansión mandibular y movilidad dental en lesiones maxilofaciales, y afectación rara de la base del cráneo con alteraciones visuales.14-17 Las dificultades respiratorias son poco comunes, salvo que las lesiones afecten estructuras de la vía aérea, como reportaron Can Ö et al.11
Los TM son infrecuentes en países desarrollados debido al tamizaje rutinario del calcio y tratamiento precoz de la hipercalcemia. Sin embargo, son más comunes en países en desarrollo como India, donde el diagnóstico tardío y el hiperparatiroidismo no tratado contribuyen a su aparición.18,19 Radiográficamente, pueden parecer tumores óseos primarios o metastásicos por su apariencia agresiva, y a menudo imitan tumores de células gigantes u osteosarcomas. Las lesiones líticas de TM con alta actividad metabólica en PET-CT son difíciles de distinguir de neoplasias malignas sin confirmación histopatológica.20-22 Khomariyah E et al. reportaron cuatro pacientes inicialmente mal diagnosticados como fibroma osificante, fibrosarcoma de fémur proximal, mieloma múltiple, quiste óseo y displasia fibrosa, lo que retrasó el tratamiento antes de confirmarse como TM.6
La fiebre, aunque atípica en el hiperparatiroidismo, puede inducir a errores diagnósticos hacia causas infecciosas o inflamatorias. Un estudio multinacional de Erdem H et al. sobre fiebre de origen desconocido (FOD) en 21 países identificó a las infecciones y el cáncer como las causas más frecuentes, seguidas de enfermedades del colágeno; las causas endocrinas fueron raras.23 Dentro de las endocrinopatías, la tiroiditis fue la más común; curiosamente, los trastornos paratiroideos no se reportaron. Donald C. et al. (1979) describieron la fiebre como manifestación poco común del hiperparatiroidismo primario (HPPT).24 Algunos reportes han documentado su presencia, particularmente en casos graves de enfermedad ósea o carcinoma paratiroideo, como lo describieron Nagpure KB et al.25 Se ha planteado la hipótesis de que citoquinas inflamatorias como IL-1, IL-6 y TNF-α, implicadas en infecciones y cáncer, también podrían liberarse durante la intensa resorción ósea del HPPT, como en los TM. Esta fiebre mediada por citoquinas, aunque plausible en casos de recambio óseo rápido, sigue siendo una teoría sin evidencia a gran escala.26
Las múltiples lesiones líticas en la pelvis inicialmente sugirieron enfermedad neoplasia metastásica (radiológicamente), lo que alteró significativamente el abordaje clínico en este caso. Sin embargo, la biopsia guiada por TC mostró las características típicas del TM—células gigantes tipo osteoclasto, estroma fibroblástico y hemorragia—excluyendo enfermedad neoplásica. Los hallazgos bioquímicos respaldaron el diagnóstico ya que la PTH estaba marcadamente elevada, indicando actividad paratiroidea autónoma. El calcio sérico estaba en el límite superior normal, probablemente enmascarado por la deficiencia concomitante de vitamina D, lo que complicó la interpretación bioquímica.
La SPECT-CT con Tc-99m tetrofosmina identificó un adenoma paratiroideo, la causa más común de HPPT. Estas modalidades de imagen son fundamentales para la localización preoperatoria con alta sensibilidad.27 En la mayoría de los casos, la paratiroidectomía normaliza los niveles de PTH y produce regresión gradual del TM. Las lesiones grandes o sintomáticas pueden requerir intervención ortopédica. El manejo posoperatorio debe incluir monitoreo para el síndrome de hueso hambriento, una condición de hipocalcemia profunda que puede ocurrir después de resecar un adenoma paratiroideo secretor de PTH debido a una rápida remineralización esquelética.28
Conclusión
Este caso destaca la necesidad de considerar trastornos endocrinos y metabólicos, particularmente el hiperparatiroidismo, en el diagnóstico diferencial de pacientes con fiebre inexplicada y lesiones óseas líticas, una vez excluidas las causas infecciosas y malignas. Aunque poco comunes, los TM deben tenerse en cuenta, especialmente en poblaciones sin tamizaje rutinario de calcio. El diagnóstico puede ser difícil debido a su similitud clínica y radiológica con la neoplasia o la osteomielitis. Se requiere un alto índice de sospecha, pruebas bioquímicas dirigidas, confirmación por imagen e histopatología para un diagnóstico certero. La identificación temprana y el tratamiento quirúrgico definitivo del hiperparatiroidismo pueden revertir los síntomas sistémicos y prevenir complicaciones óseas adicionales.
Financiamiento: los autores declaran que el trabajo no tuvo financiamiento.
Conflictos de interés: los autores declaran que no tienen conflictos de intereses relacionados con el tema de esta publicación.
Contribuciones de los autores: AA, DG, SC, SB, PD: conceptualización/diseño. AA, DG, SC, SB, PD: metodología. AA, DG, SB, PD: investigación. AA, DG, SC, SB, PD: curaduría de datos. AA, DG, SC: recursos. SC, DG: redacción borrador original. AA, DG, SC, SB, PD: revisión. AA, DG, SC, SB, PD: edición. AA, DG, SC, SB, PD: supervisión/validación.
El Editor en Jefe, Dr. Carlos Luna, realizó el seguimiento del proceso de revisión y aprobó este artículo.
Referencias
1. Diacinti D, Cipriani C, Biamonte F et al. Imaging technologies in the differential diagnosis and follow-up of brown tumor in primary hyperparathyroidism: Case report and review of the literature. Bone Rep 2020;14:100745. Doi: 10.1016/j.bonr.2020.100745.
2. Guedes A, Becker RG, Nakagawa SA, Guedes AAL. Update on brown tumor of hyperparathyroidism. Rev Assoc Med Bras (1992) 2024;70(suppl 1): e2024S132. Doi: 10.1590/1806-9282.2024S132.
3. Zhong Y, Huang Y, Luo J, Ye Y. Misdiagnosis of brown tumour caused by primary hyperparathyroidism: a case report with literature review. BMC Endocr Disord 2022;22(1):66. Doi: 10.1186/s12902-022-00971-2.
4. Rosenberg AE, Nielsen GP. Giant cell containing lesions of bone and their differential diagnosis. Curr Diagn Pathol 2001;7:235-246. Doi: 10.1054/cdip.2001.0080.
5. Etemadi J, Mortazavi-Khosrowshahi M, Ardalan MR, Esmaili H, Javadrashid R, Shoja MM. Brown tumor of hyperparathyroidism masquerading as central giant cell granuloma in a renal transplant recipient: a case report. Transplant Proc 2009;41(7):2920-2. Doi: 10.1016/j.transproceed.2009.07.040.
6. Khomariyah E, Purnamasari Y, Basuki MH, Massora S. Diagnostic challenge of the brown tumors in developing country: A case series. Int J Surg Case Rep 2024;123:110221. Doi: 10.1016/j.ijscr.2024.110221.
7. Samir K. El-Mofty, Chapter 9 - Bone Lesions. En: Douglas R. Gnepp. Diagnostic Surgical Pathology of the Head and Neck (Second Edition), W.B. Saunders, 2009; pp. 729-784.
8. Tayfun H, Metin O, Hakan S, Zafer B, Vardar AF. Brown tumor as an unusual but preventable cause of spinal cord compression: Case report and review of the literature. Asian J Neurosurg 2014;9(1):40-44. Doi: 10.4103/1793-5482.131074.
9. Anastasopoulou C, Naji Rad S, Barnett MJ et al. Osteitis Fibrosa Cystica. StatPearls. Treasure Island (FL), 2025. [Internet]. [Consultado 6 feb 2025]. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK559097/.
10. Choi JH, Kim KJ, Lee YJ et al. Primary Hyperparathyroidism with Extensive Brown Tumors and Multiple Fractures in a 20-Year-Old Woman. Endocrinol Metab (Seoul) 2015;30(4):614-619. Doi: 10.3803/EnM.2015.30.4.614.
11. Can Ö, Boynueğri B, Gökçe AM, Özdemir E, Ferhatoğlu F, Canbakan M. Brown Tumors: A Case Report and Review of the Literature. Case Rep Nephrol Dial 2016;6(1):46-52. Doi:10.1159/000444703.
12. Wasiak M, Popow M, Bogdańska M, Starzyńska-Kubicka A, Małdyk P, Wasilewski P. Treatment of pathological fractures due to brown tumours in a patient with hyperparathyroidism and lack of parafibromin expression - A case report. Trauma Case Rep 2020;30:100367. Doi: 10.1016/j.tcr.2020.100367.
13. Pinto M, Gaffrée, Santos R et al. Brown tumour revealed: A literature review with a case study. Biomed J Sci & Tech 2017;1:7. Doi : 10.26717/BJSTR.2017.01.000587.
14. Arsalanizadeh B, Westacott R. Osteoclastomas (‘brown tumours’) and spinal cord compression: a review. Clin Kidney J 2013;6(2):220-3. Doi: 10.1093/ckj/sft021.
15. Antin F, Bakhos D, Jegoux F, Merkouza M, Laccourreye L. Maxillofacial brown tumours: Series of 5 cases. Eur Ann Otorhinolaryngol Head Neck Dis 2018;135(4):227-230. Doi: 10.1016/j.anorl.2018.03.005.
16. Esselmani H, Aimrane A, Chatoui H, El Hiba O, Najimi M, Merzouki M. Severe Headache and Deterioration of Vision in Left Eye in a Chronic Hemodialysis Patient Revealing a Brown Tumor of Sphenoid Sinus. Neurol Int 2025;17(2):22. Doi: 10.3390/neurolint17020022.
17. Zhou Z, Shi Y, Li C, Wang W. Primary hyperparathyroidism-induced brown tumors caused by parathyroid carcinoma: a case report and literature review. J Int Med Res 2022;50(9):03000605221123668. Doi: 10.1177/03000605221123668.
18. Qaisi M, Loeb M, Montague L, Caloss R. Mandibular Brown Tumor of Secondary Hyperparathyroidism Requiring Extensive Resection: A Forgotten Entity in the Developed World? Case Rep Med 2015;2015:567543. Doi: 10.1155/2015/567543.
19. Chatterji P, Rastogi R, Mukherjee Y, Jain R. Brown Tumor of Mandible—A Rare Presenting Complaint of Hyperparathyroidism. J Maxillofac Oral Surg 2024. Doi: 10.1007/s12663-024-02413-z
20. Dinoi E, Prete A, Sardella C et al. The challenge of the differential diagnosis between brown tumors and metastases in parathyroid carcinoma: a case report. Front Endocrinol (Lausanne) 2024;15:1414896. Doi: 10.3389/fendo.2024.1414896.
21. Herrera Ortiz AF, Olarte L, Del Castillo V, Duarte JN, Rojas J, Aguirre D. Brown tumors mimicking multiple myeloma: A case report. Radiol Case Rep 2024;20(1):841-845. Doi: 10.1016/j.radcr.2024.10.055.
22. Diacinti D, Cipriani C, Biamonte F et al. Imaging technologies in the differential diagnosis and follow-up of brown tumor in primary hyperparathyroidism: Case report and review of the literature. Bone Rep 2020;14:100745. Doi: 10.1016/j.bonr.2020.100745.
23. Erdem H, Baymakova M, Alkan S et al. Classical fever of unknown origin in 21 countries with different economic development: an international ID-IRI study. Eur J Clin Microbiol Infect Dis 2023;42(4):387-398. Doi: 10.1007/s10096-023-04561-5.
24. Blair DC, Fekety FR. Primary hyperparathyroidism presenting as fever of unknown origin with unremitting headache. Ann Intern Med 1979;91(4):575-6. Doi: 10.7326/0003-4819-91-4-575.
25. Nagpure KB, Kumbhalkar S, Dube A, Indu S. Fever of Unknown Origin: A Rare Presentation of Parathyroid Carcinoma. Cureus 2024;16(12):e75868. Doi: 10.7759/cureus.75868.
26. Conti B, Tabarean I, Andrei C, Bartfai T. Cytokines and fever. Front Biosci 2004;9:1433-49. Doi: 10.2741/1341.
27. Piciucchi S, Barone D, Gavelli G, Dubini A, Oboldi D, Matteuci F. Primary hyperparathyroidism: imaging to pathology. J Clin Imaging Sci 2012;2:59. Doi: 10.4103/2156-7514.102053.
28. Cartwright C, Anastasopoulou C. Hungry Bone Syndrome. StatPearls. Treasure Island (FL), 2025. [Internet]. [Consultado 6 feb 2025]. Disponible en: https://www.ncbi.nlm.nih.gov/books/NBK549880/