ARTÍCULO ORIGINAL | Respirar, 2025; 17(3): 219-254 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.17.3.2
Laura Mendoza
https://orcid.org/0000-0001-5426-0439
Efraín Sánchez-Angarita
https://orcid.org/0000-0001-8189-2482
David Torres
https://orcid.org/0000-0003-2908-6365
Juan Pablo Valenzuela
https://orcid.org/0000-0003-0077-3495
Mark Cohen
https://orcid.org/0000-0003-0222-3817
Rogelio Pérez Padilla
https://orcid.org/0000-0002-1132-5308
Recibido:
20 abril 2025
Aceptado
2 julio 2025
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
Abordando los desafíos de la EPOC en Latinoamérica: preguntas y respuestas basadas en metodología GRADE
Addressing the Challenges of COPD in Latin America: Questions and Answers Based on the GRADE Methodology
Laura Mendoza1,2 , Efraín Sánchez–Angarita3
, Efraín Sánchez–Angarita3 , David Torres4
, David Torres4 ,
,
Juan Pablo Valenzuela5 , Mark Cohen6
, Mark Cohen6 , Rogelio Pérez Padilla7
, Rogelio Pérez Padilla7
1.Universidad de Chile, Hospital Clínico, Sección Neumología, Santiago, Chile.
2. Universidad del Desarrollo, Clínica Alemana de Santiago, Servicio Broncopulmonar, Santiago, Chile.
3. Omni Hospital y MEDEX Program, Guayaquil, Guayas, Ecuador.
4. Universidad de Los Andes, Santiago, Chile.
5. Pontificia Universidad Católica de Chile, Facultad de Medicina, Escuela de Medicina, Santiago, Chile.
6. Hospital Centro Médico, Ciudad de Guatemala, Guatemala.
7. Instituto Nacional de Enfermedades Respiratorias (INER), Departamento EPOC y Tabaquismo, Ciudad de México, México.
COLABORADORES
Representantes de Sociedades Respiratorias Nacionales
Representantes de Departamentos Científicos ALAT
Colaborador manejo editorial
Autor CORRESPONSAL:
Efraín J. Sánchez–Angarita, epoc@alatorax.org
Resumen
Introducción: La enfermedad pulmonar obstructiva crónica (EPOC) representa un importante desafío para la salud pública en América Latina, contribuyendo sustancialmente a la morbilidad y la mortalidad. Este documento busca brindar recomendaciones basadas en la evidencia para el diagnóstico y el tratamiento de la EPOC en América Latina, adaptadas a las necesidades y recursos específicos de la región. Su propósito es servir de guía para los profesionales de la salud en sus esfuerzos por mejorar la calidad de vida de las personas con EPOC.
Metodología: Se estableció el comité ejecutivo de las recomendaciones conformado por cuatro médicos neumólogos miembros del departamento de EPOC de ALAT y dos epidemiólogos clínicos. Representantes de sociedades nacionales de Neumología y representantes de departamentos científicos de ALAT, quienes formularon preguntas clínicas; se seleccionaron 12 preguntas por su relevancia para contexto latinoamericano. Luego, se utilizó el sistema GRADE (Grading of Recommendations Assessment, Development and Evaluation) para evaluar la evidencia disponible y formular las recomendaciones.
Resultados: Se obtuvieron recomendaciones en 12 preguntas PICO divididas en cuatro apartados: prevención secundaria, pronóstico I, pronóstico II y terapéutica.
Conclusiones: El objetivo del presente documento es proporcionar recomendaciones de relevancia para el diagnóstico y tratamiento de la EPOC en Latinoamérica, que sean aplicables para médicos especialistas y de atención primaria con la finalidad de reducir el impacto asistencial y los costos asociados a la enfermedad.
Palabras clave: recomendaciones, enfermedad pulmonar obstructiva crónica, diagnóstico, pronóstico, tratamiento, GRADE.
Abstract
Introduction: Chronic obstructive pulmonary disease (COPD) represents a major public health challenge in Latin America, contributing substantially to morbidity and mortality. This document seeks to provide evidence-based recommendations for the diagnosis and treatment of COPD in Latin America, tailored to the specific needs and resources of the region. Its purpose is to serve as a guide for healthcare professionals in their efforts to improve the quality of life of people with COPD.
Methods: An executive committee for the recommendations was established, consisting of four pulmonologists from the COPD Department of ALAT and two clinical epidemiologists. Representatives of national pulmonology societies and representatives of ALAT scientific departments formulated clinical questions, and twelve questions were selected based on their relevance to the Latin American context. The GRADE (Grading of Recommendations Assessment, Development and Evaluation) system was then used to evaluate the available evidence and formulate recommendations.
Results: Recommendations were obtained in 12 PICO questions divided into four sections: secondary prevention, prognosis I, prognosis II and therapeutics.
Conclusions: The objective of this document is to provide recommendations for the diagnosis and treatment of COPD relevant to Latin America, applicable to specialists and primary care physicians, with the goal of reducing the healthcare impact and costs associated with the disease.
Keywords: recommendations, chronic obstructive pulmonary disease, diagnosis, prognosis, treatment, GRADE.
Introducción
La enfermedad pulmonar obstructiva crónica (EPOC) es una condición pulmonar heterogénea. En 2022 la Lancet Commission para la eliminación de la EPOC1 destaca la necesidad de reducir la carga de la enfermedad con las estrategias de cesación tabáquica y manejo de la EPOC secundaria al tabaco, pero reconoce varios factores de riesgo diferentes al tabaco en la etiología de la EPOC que son relevantes en Latinoamérica (LA). Varias normativas internacionales han adoptado esta clasificación de factores de riesgo de la EPOC, reconociendo que existe escasa evidencia sobre las recomendaciones en el diagnóstico y tratamiento en estos etiopitos.
La aplicabilidad de las recomendaciones de normativas en el manejo de la EPOC en fumadores presenta limitaciones por el pobre acceso y poder adquisitivo a los tratamientos y métodos diagnósticos actuales en Latinoamérica.2 Además, se reconoce que la prevalencia de EPOC no relacionado a tabaco en Latinoamérica es frecuente,3–5 particularmente en los países de bajos y medianos recursos, y se dispone de escasa evidencia sobre la efectividad de las intervenciones terapéuticas en estos pacientes, lo que ha llevado a la necesidad de aplicar los resultados conocidos en pacientes con EPOC fumadores a aquellos no fumadores.
Por estas razones, el Departamento de EPOC, junto con las sociedades nacionales afiliadas de ALAT, se comprometieron a desarrollar recomendaciones para el diagnóstico y tratamiento de la EPOC que se ajusten de mejor manera a la diversidad socio-geográfica y cultural de Latinoamérica, utilizando preguntas clínicas en formato PICO y la metodología GRADE.
Metodología
La metodología de este documento sigue los lineamientos de las orientaciones “Guidelines 2.0” para el desarrollo de recomendaciones basadas en evidencia.6 La certeza de la evidencia y la calificación de las recomendaciones se realizaron según la metodología GRADE.7–11 Además, la organización y gestión del desarrollo del documento, incluyendo financiamiento y conflictos de interés, siguieron la “Guideline International Network-McMaster Guideline Development Checklist”.12
Organización y composición del panel
El panel estuvo integrado por cuatro especialistas en neumología (ES, LM, MC, RP) y dos epidemiólogos clínicos (DT, JV), quienes se encargaron de coordinar la revisión de la evidencia y la elaboración de recomendaciones. Asimismo, cada neumólogo trabajó en conjunto con expertos latinoamericanos para validar el desarrollo de la guía. Los médicos formaban parte de la Asociación Latinoamericana de Tórax (ALAT), siendo la coordinadora general la Dra. Laura Mendoza, quien se desempeñó como directora del Departamento de EPOC de la ALAT en el período 2022-2024, seguida por el Dr. Efraín Sánchez en el periodo 2024-2026. Los epidemiólogos guiaron la síntesis de la evidencia y facilitaron la discusión en el panel. Las reuniones se realizaron mediante Microsoft Excel, Google Forms y Zoom.
Financiamiento y gestión de conflictos de interés
La elaboración del documento fue financiada de manera exclusiva por ALAT, una sociedad médica sin ánimo de lucro. Los neumólogos contribuyeron sin retribución económica, mientras que los epidemiólogos recibieron subvenciones a través de ALAT. La gestión de conflictos de interés siguió las recomendaciones del Institute of Medicine y la Guideline International Network.12,13 Ninguno de los epidemiólogos presentaba conflictos de interés comerciales que pudieran influir en la guía.
Formulación de preguntas clínicas y desenlaces
Los representantes de las sociedades científicas nacionales y los directores del departamento de EPOC de ALAT presentaron sus propuestas de preguntas, enfocándose en las particularidades y los desafíos que presenta la EPOC en la región. Posteriormente, se realizó un proceso de priorización a través de encuestas y reuniones virtuales, lo que facilitó la selección de las preguntas clínicas más relevantes para el contexto latinoamericano.
Se seleccionaron desenlaces de interés categorizados como “críticos”, “importantes” o “sustitutos”. Entre los desenlaces críticos, se incluyeron la mortalidad, calidad de vida y eventos adversos graves.
Revisión de la evidencia y elaboración de recomendaciones
Se utilizó la matriz “Evidence to Decision” (EtD) basada en GRADEpro para sintetizar la información de revisiones sistemáticas.14 Se analizaron los efectos de las intervenciones, la utilización de recursos sanitarios, equidad, aceptabilidad e implementación. La búsqueda de revisiones sistemáticas se realizó en MEDLINE, Embase y la Librería Cochrane hasta el 1 de julio de 2024. Se realizaron meta-análisis utilizando modelos de efectos aleatorios de Mantel-Haenszel utilizando RevMan 5.3, y se exploró la heterogeneidad mediante pruebas chi cuadrado e I2 (≥ 60% considerado significativo).
El sesgo de publicación se evaluó mediante funnel plots y la certeza de la evidencia se determinó según los dominios de riesgo de sesgo, precisión, consistencia, evidencia directa y sesgo de publicación.9,10 La certeza global se categorizó en muy baja, baja, moderada o alta. No se identificaron estudios específicos de costos y valores en Latinoamérica para estas intervenciones.
Las recomendaciones finales fueron fuertes o condicionales, y estar a favor o en contra de la intervención, lo que aseguró rigor y transparencia en su formulación.
Justificación, evidencia y recomendaciones
Pregunta 1: ¿Cuál es el impacto clínico de la educación individual en inhaloterapia comparada con el cuidado habitual en los pacientes con EPOC?
Justificación
Para que la terapia inhalatoria tenga beneficios clínicos en pacientes con EPOC, es importante que la técnica se aplique correctamente. Actualmente, en LA hay gran variedad de dispositivos inhalatorios, con diferentes técnicas de inhalación. La técnica subóptima puede limitar la eficacia de la terapia inhalatoria. A pesar de que se considera que la educación en inhaloterapia es breve, es habitual que tanto los médicos como el personal de salud no la realicen. Existen dudas sobre el verdadero impacto clínico de la educación individual en inhaloterapia para los pacientes con EPOC.
Resumen de la evidencia
Se analizó la implementación de la educación individual de inhaloterapia de forma verbal y mediante demostración realizada por profesionales sanitarios previamente entrenados, se complementó con la entrega de material informativo adicional, que incluye instrucciones escritas en folletos, manuales y demostración en videos. El grupo control no recibió educación, solo manejo habitual.
Se incluyeron ocho ensayos controlados aleatorizados,15–22 con un total de 1.715 pacientes, en los cuales se reportó el número de exacerbaciones y hospitalizaciones, la calidad de vida y el uso correcto de la inhaloterapia.
Comparado con el tratamiento habitual, la educación individual en inhaloterapia probablemente reduce el número de exacerbaciones con certeza de la evidencia moderada. (Material suplementario: Tabla S1.2, Figura S1.1). También podría tener un impacto en reducir el número de hospitalizaciones y mejorar la calidad de vida, pero con baja certeza de la evidencia. (Material suplementario: Tabla S1.2, Figuras S1.2 y S1.3)
La educación individual en inhaloterapia podría asociarse a una mejor técnica inhalatoria (Material suplementario: Tabla 1.2, Figura 1.4). Este resultado no se considera crítico, pero sí importante para lograr los resultados críticos como los descritos anteriormente, sin embargo, existe considerable incertidumbre dado que la certeza de la evidencia es muy baja.
Recomendación: En pacientes con EPOC, ALAT RECOMIENDA realizar educación individual en inhaloterapia comparado con no realizarla.
(Recomendación condicional a favor, certeza de la evidencia baja)
Comentarios del panel: La instrucción individual en inhaloterapia puede ser impartida de forma verbal mediante demostraciones realizadas por profesionales sanitarios debidamente entrenados, complementándose con material informativo adicional que incluya instrucciones escritas en folletos y demostraciones en video.
Pregunta 2: ¿Cuál es el impacto clínico del incentivo de la actividad física (AF) comparado con el cuidado habitual en los pacientes con EPOC?
Justificación
Es conocido que la AF se encuentra disminuida en los pacientes con EPOC,23,24 lo que también se ha documentado en LA.25
La baja AF impacta negativamente en la EPOC, asociándose con una mayor mortalidad y frecuencia de hospitalizaciones por exacerbaciones,25,26 mayor disnea,27 peor calidad de vida28 y menor fuerza muscular.29
Se desconoce si las intervenciones que incentivan a la AF conducen a una reducción del sedentarismo de los pacientes con EPOC.
Resumen de la evidencia
Se identificaron siete estudios aleatorizados que analizaron programas de incentivo de la AF en un total de 1.070 pacientes con EPOC, en los cuales se compararon estos programas con el cuidado usual.
Los programas de incentivo de AF incluyeron diversas intervenciones: caminatas grupales supervisadas de 30 a 45 minutos,30 asesoría personalizada para aumentar la AF,31 “Urban Training” con mapas de rutas y apoyo continuo,32 aplicación y sitio web para monitorear AF,33 uso de podómetros con ajuste de metas,34 tele asesoría con aplicaciones móviles35 y un programa de ejercicio postrehabilitación con circuitos urbanos y registro de caminatas.36 (Material suplementario: Tabla S2.1)
Los programas de incentivo de AF pueden tener un efecto pequeño en las exacerbaciones y un efecto pequeño-moderado en la calidad de vida, aunque podrían no tener efecto en la capacidad funcional en pacientes con EPOC. La certeza global de la evidencia fue muy baja, dado el riesgo de sesgo y heterogeneidad de los estudios y la imprecisión de los resultados. (Material suplementario: Tablas S2.1 y S2.2; Figuras: S2.1, S2.2 y S2.3)
Recomendación: En pacientes con EPOC, ALAT RECOMIENDA la implementación de programas de incentivo de la AF en combinación con el cuidado habitual, comparado con realizar solo cuidado habitual. (Recomendación condicional a favor, certeza de la evidencia baja).
Comentarios del panel: Las diversas intervenciones a promover la AF en pacientes con EPOC se consideran relativamente sencillas de implementar en LA, dado que presentan un bajo costo y pueden implementarse en atención primaria.
Pregunta 3: ¿Cuál es el impacto clínico del entrenamiento de músculos inspiratorios (EMI) comparado con el cuidado habitual en los pacientes con EPOC?
Justificación
Desde la década de 1970, se ha investigado la función del EMI en los pacientes con EPOC. Varios estudios demuestran los efectos sobre la fuerza muscular inspiratoria, ya sea como intervención única37 o como parte de programas de rehabilitación pulmonar.38 La fuerza muscular inspiratoria disminuye en la EPOC debido al acortamiento del diafragma por la hiperinflación pulmonar, pero se mantiene la fuerza muscular normal respecto a su nivel de acortamiento.39
La justificación de esta pregunta se fundamenta en la falta de claridad del impacto clínico que la EMI tiene en pacientes con EPOC.
Resumen de la evidencia
Se identificó una revisión sistemática con metaanálisis que evaluó desenlaces relevantes sobre el EMI más rehabilitación respiratoria en comparación con rehabilitación respiratoria o del EMI comparado con control/sham, en 2.467 pacientes con EPOC.40
Se incluyeron diferentes tipos de EMI: entrenamiento de resistencia (carga alta/baja frecuencia y carga baja/alta frecuencia) y de dispositivos (carga umbral, dispositivo de flujo resistivo, hiperpnea isocápnica). La rehabilitación respiratoria incluyó entrenamiento físico, fisioterapia, educación terapéutica, atención nutricional y psicosocial.
La evidencia es incierta respecto al efecto en la disnea y la capacidad funcional en la combinación de EMI más rehabilitación pulmonar, en comparación con rehabilitación pulmonar sola (certeza de evidencia muy baja). (Material suplementario: Tabla S3.1)
Esta combinación podría no tener ninguna diferencia o una diferencia pequeña en la calidad de vida en comparación con la rehabilitación pulmonar sola (certeza de la evidencia baja). (Material suplementario: Tabla S3.2)
El EMI comparado con la intervención control/sham podría mejorar la disnea (certeza de la evidencia baja). Probablemente, mejore la capacidad funcional (certeza de la evidencia moderada) y quizás mejore la calidad de vida, pero existe considerable incertidumbre porque la certeza de la evidencia es muy baja. (Material suplementario: Tabla S3.3)
La certeza global de la evidencia con relación al impacto benéfico fue evaluada como muy baja, dado el riesgo de sesgo de la mayoría de los estudios identificados y por la imprecisión de los resultados debido al tamaño óptimo de la información (menos de 400 sujetos) en algunos de los desenlaces críticos. (Material suplementario: Tabla S3.3)
Recomendación: En pacientes con EPOC, ALAT RECOMIENDA no incorporar el entrenamiento de músculos inspiratorios de forma rutinaria y de forma aislada al cuidado habitual, sino en conjunto con un programa de rehabilitación respiratoria. (Recomendación condicional en contra, certeza de la evidencia baja).
Comentarios del panel: Existen múltiples modalidades de entrenamiento muscular inspiratorio, siendo importante diferenciar si se implementan solos o en combinación con un programa de rehabilitación respiratoria. La síntesis de evidencia no describe un impacto clínico significativo; sin embargo, los profesionales sanitarios han indicado que este entrenamiento podría tener efecto significativo cuando se adapta de forma individualizada a cada paciente.
Pregunta 4: ¿Cuál es el riesgo para desarrollar EPOC en fumadores con espirometría anormal no obstructiva (patrón PRISm) en comparación con fumadores con espirometría normal?
Justificación
La espirometría anormal con cociente VEF1/CVF preservado (Preserved Ratio Impaired Spirometry, PRISm), ha sido objeto de estudio reciente por su asociación con incremento en la mortalidad, enfermedades cardíacas y metabólicas. Este patrón con frecuencia puede transitar hacia otros patrones, incluyendo el obstructivo, en particular en fumadores. Por lo expuesto, resulta relevante investigar el riesgo de desarrollar EPOC en pacientes fumadores con patrón PRISm en la espirometría.
Resumen de la evidencia
Se identificaron cuatro estudios de cohorte con un total de 6.827 individuos fumadores sin EPOC, expuestos a una medición de espirometría basal y con posterior seguimiento.41–44 (Material suplementario: Tabla S4.1)
En una cohorte con un seguimiento a tres años, la incidencia de EPOC en los sujetos con patrón PRISm fue significativamente superior comparada con aquellos con espirometría normal.44 Una cohorte prospectiva con un seguimiento a 4,5 años mostró que la progresión hacia EPOC en sujetos con patrón PRISm fue mayor comparada con aquellos con espirometría normal.42
La cohorte de seguimiento de COPDGene® muestra que de los 1.375 participantes con estadio GOLD 0, el 6,8% progresó hacia estadio GOLD 1 y el 2,0% a GOLD 2–4. En la Fase 2 (seguimiento a cinco años), 36% de los participantes disponibles para el análisis de progresión PRISm en la Fase 1 progresaron hacia GOLD 2–4 en la Fase 2. No hubo conversión de PRISm a GOLD 0 o a GOLD 1 en la Fase 2.41
El estudio PLATINO longitudinal muestra que del grupo PRISm el 19,8% progresó hacia EPOC. Mientras que, en el grupo de los sujetos con espirometría normal, solo el 7,9% progresó hacia EPOC.43
La certeza global de la evidencia fue evaluada como muy baja, dado el riesgo de sesgo y el diseño de los estudios identificados. (Material suplementario: Tabla S4.2)
Recomendación: ALAT CONSIDERA que en individuos fumadores con espirometría anormal no obstructiva (patrón PRISm), existe un incremento en la incidencia de EPOC en comparación con aquellos fumadores con espirometría normal. (Recomendación condicional a favor, certeza de la evidencia muy baja).
Comentarios del panel: En sujetos con un patrón espirométrico PRISm que continúan fumando, se debe enfatizar en las estrategias de cesación tabáquica (farmacológicas y/o no farmacológicas), y en realizar seguimiento cada 6-12 meses incluyendo una espirometría con broncodilatador durante la consulta.
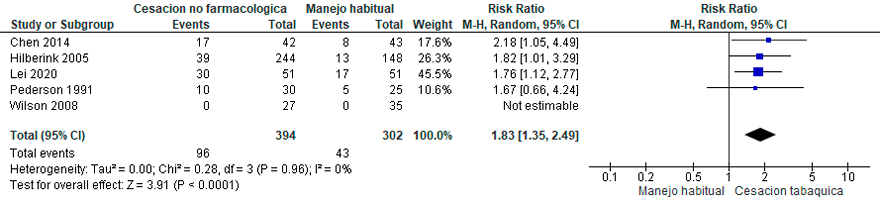
Pregunta 5: ¿Cuál es el riesgo de hospitalizar y de morir en pacientes con EPOC tabáquico que continúan fumando en comparación con los que dejan de fumar?
Justificación
La cesación tabáquica constituyó la primera intervención capaz de modificar la historia natural de la EPOC y reducir la mortalidad, siendo durante muchos años la única reconocida. La investigación del riesgo de hospitalización y mortalidad en pacientes con EPOC relacionada con el tabaquismo, los que persisten fumando en comparación con aquellos que dejan de fumar, es fundamental para entender el impacto del tabaquismo en la progresión de la enfermedad.
Resumen de la evidencia
Se analizaron cinco estudios de cohorte.45–48 Los fumadores con EPOC podrían presentar mayores riesgos de mortalidad por todas las causas y mortalidad relacionada con enfermedades respiratorias en comparación con los no fumadores.
Los fumadores activos tienen una estancia hospitalaria mayor en comparación con los exfumadores, fumadores pasivos y no fumadores. Sin embargo, esta diferencia podría carecer de significancia estadística al ajustarse por la puntuación basal mMRC, la gravedad de la tos, el índice de oxigenación y la PaCO2. (Material suplementario: Tablas S5.1 y S5.2)
No fue posible determinar el efecto único para el riesgo de hospitalización y mortalidad en los estudios analizados.
La certeza global de la evidencia fue evaluada como muy baja, dadas las características de estudios observacionales con elevado riesgo de sesgo. Se requieren más estudios longitudinales para aumentar la certeza en esta conclusión. (Material suplementario: Tablas S5.1 y S5.2).
Recomendación: En pacientes con EPOC, ALAT CONSIDERA que el tabaquismo activo aumenta el riesgo de hospitalización y de mortalidad, por causa respiratoria y por todas las causas. (Recomendación condicional a favor, certeza de la evidencia muy baja).
Comentarios del panel: En pacientes con diagnóstico de EPOC se debe enfatizar en estrategias de cesación tabáquica (farmacológicas y/o no farmacológicas) con el objetivo de reducir las exacerbaciones severas y mortalidad.
Pregunta 6: ¿Cuál es el impacto clínico de la terapia broncodilatadora en pacientes con EPOC que siguen fumando?
Justificación
Aproximadamente, el 40% de los pacientes con EPOC que reciben tratamiento inhalado regular continúan fumando.49 La cesación tabáquica se asocia a una menor declinación en la función pulmonar.50 Por otro lado, el uso de medicamentos inhalados puede resultar en mejoras significativas en la función pulmonar, en la calidad de vida y en el riesgo de exacerbaciones en los pacientes con EPOC que continúan fumando, por lo que es importante aclarar la interacción entre el tabaquismo activo y el uso de broncodilatadores inhalados.
Resumen de la evidencia
Se incluyeron cuatro ECA que incluyeron 18.530 pacientes con EPOC fumadores y no fumadores.51–54 Los pacientes con EPOC intervenidos con broncodilatadores inhalados que continuaban fumando tuvieron una diferencia en el cambio absoluto y en la mediana de las pendientes de VEF1, en comparación con los que dejaron fumar (Material Suplementario: Tablas S6.1 y S6.2; Figura S6)
La certeza global de la evidencia fue evaluada como baja, dado el riesgo de sesgo de la mayoría de los estudios identificados y por la heterogeneidad en el desenlace importante.
Recomendación: En pacientes con EPOC que reciben tratamiento con broncodilatadores y que continúan fumando, ALAT CONSIDERA que tanto el cambio de los valores absolutos del VEF1, como su declinación parecen descender de forma más acelerada en aquellos que continúan fumando, comparado con aquellos exfumadores, a pesar de la terapia broncodilatadora. (Recomendación condicional a favor, certeza de la evidencia baja).
Comentarios del panel: Aunque es fundamental tratar con terapia broncodilatadora a pacientes con EPOC fumadores y exfumadores, se requiere promover la cesación tabáquica, dado su impacto en el descenso de la función pulmonar. Es necesario tipificar a fumadores y exfumadores en futuros estudios para evaluar las posibles diferencias en la efectividad de nuevas combinaciones de broncodilatadores.
Pregunta 7: ¿Cuáles son los pacientes con EPOC que al recibir oxigenoterapia domiciliaria presentan reducción de mortalidad?
Justificación
A partir de los estudios NOTT (Nocturnal Oxygen Therapy Trial)55 y el realizado por el Medical Research Council (MRC) en Inglaterra,56 se ha considerado que la oxigenoterapia crónica domiciliaria está indicada en pacientes con EPOC e hipoxemia grave, definida como una PaO2 ≤ 55 mmHg, o bien < 60 mmHg con evidencia de respuesta a la hipoxia o presencia de edema. Estos criterios se han mantenido como un estándar57 y siguen vigentes en las normativas para la provisión de oxígeno domiciliario recomendadas por organizaciones internacionales.58–60 Esta aplicación es válida en diversas patologías y altitudes residenciales a pesar de haberse generado para pacientes con EPOC en localidades cercanas al nivel del mar.
Es pertinente preguntarse cuáles son los grupos de pacientes con EPOC que podrían beneficiarse de una disminución de la mortalidad al recibir oxigenoterapia domiciliaria.
Resumen de la evidencia
En la revisión realizada para la actualización, se identificaron seis ensayos clínicos aleatorizados con hipoxemia moderada (PaO2>55), sin evidencia de reducción significativa en la mortalidad con el uso del oxígeno.61–66 (Material suplementario: Tabla S6.1, S6.2)
En pacientes con hipoxemia nocturna sin hipoxemia grave, no se ha demostrado una mejoría en la sobrevida,62 ni en el deterioro hemodinámico,67 ni en el tiempo para la transición a oxígeno continuo por cumplir los criterios de hipoxemia grave.68 Sin embargo, un ensayo clínico controlado logró una reducción en la presión media de la arteria pulmonar.61 (Material suplementario: Tabla S6.1, S6.2, Figura S7)
En un estudio aleatorizado reciente en 241 pacientes con hipoxemia grave (70% con EPOC), se observó que la prescripción de oxígeno durante 15 horas proporcionó resultados similares a la prescripción de oxígeno por 24 horas respecto a la sobrevida y las hospitalizaciones en un año. Es decir, el uso del oxígeno debe mantenerse al menos durante 15 horas diarias.69
En pruebas de laboratorio, se observó que el uso de oxígeno durante el ejercicio mejora ligeramente la distancia recorrida y el tiempo de ejercicio,70 aunque no mejoró la sobrevida en comparación con aquellos que no usaron oxígeno.61 El uso de oxígeno en pacientes con EPOC que presentan desaturación tampoco ha mostrado una mejoría en la distancia recorrida en 6 minutos, en el shuttle test, ni en el grado de disnea evaluado mediante la escala de Borg al terminar la prueba.71 En una revisión Cochrane, se observó que el uso de oxígeno ambulatorio mejoró la disnea y la fatiga al terminar el ejercicio; sin embargo, no hubo cambios en la sobrevida ni en el desempeño de la caminata de 6 minutos.72
Como tratamiento paliativo, se ha demostrado que el oxígeno suplementario es eficaz para mejorar la disnea solamente durante el ejercicio,73 incluso en pacientes con EPOC sin hipoxemia o con hipoxemia leve.73 Después de una hospitalización, entre el 40-60% de los pacientes con EPOC pueden experimentar mejoría progresiva y recuperarse de la hipoxemia grave; por ende, es pertinente reevaluar la hipoxemia y la necesidad de oxígeno domiciliario.74–76
Recomendaciones:
– En pacientes con EPOC e hipoxemia grave, ALAT RECOMIENDA el uso de oxígeno suplementario al menos durante 15 horas diarias, en lugar de no usarlo. (Recomendación condicional a favor, certeza de la evidencia baja)
– En caso de hipoxemia moderada (PaO2>55 mmHg) sin evidencias de policitemia o hipertensión pulmonar, ALAT RECOMIENDA no usar oxígeno domiciliario suplementario a largo plazo. (Recomendación condicional a favor, certeza de la evidencia baja)
Comentarios del panel: En pacientes sin hipoxemia grave diurna, la oxigenoterapia nocturna y durante el ejercicio en aquellos con desaturación ofrece beneficios marginales. Las indicaciones del oxígeno derivadas de pacientes con EPOC en centros cercanos a nivel del mar han sido extrapoladas a otras patologías respiratorias, en diferentes grupos etarios y altitudes geográficas. Esto demanda una valoración empírica que es necesaria para determinar la costo-efectividad de las diferentes opciones para la provisión de oxígeno suplementario, las cuales pueden presentar variaciones regionales.
Pregunta 8: ¿Hay diferencias en el riesgo de hospitalizar y de morir entre la triple terapia en dispositivo único o múltiple en pacientes con EPOC?
Justificación
Conforme a las directrices de la ALAT-2019, el uso de triple terapia (TT) en pacientes con EPOC debe reservarse a aquellos con VEF1 ≤65% que continúen experimentando compromiso en su calidad de vida, a pesar de recibir doble terapia broncodilatadora (LABA + LAMA) o terapia combinada (LABA/CI), especialmente en los que tienen un patrón eosinofílico o características propias del asma.77
La TT está disponible en un solo inhalador (SITT, por sus siglas en inglés) y en dispositivos separados (MITT, por sus siglas en inglés).78,79 Los pacientes que usan medicamentos inhalados una vez al día tienen una mayor adherencia en comparación con aquellos que se administran dos o más veces al día.80–82
La disponibilidad de la SITT en nuestra región es limitada, por lo que es pertinente analizar su efectividad en la reducción de exacerbaciones y mortalidad en comparación con los MITT en pacientes con EPOC.
Resumen de la evidencia
Se identificaron seis estudios aleatorizados con un total de 6.993 pacientes con EPOC. Estos evaluaron programas de triple terapia cerrada (en dispositivo único, SITT).83–88 Los hallazgos indicaron que el uso de la SITT tuvo un efecto no significativo o que podría ser trivial en términos de mortalidad, frecuencia de exacerbaciones y calidad de vida en comparación con los pacientes que usaron MITT. (Material suplementario: Tablas: S8.1 y 8.2; Figuras: S8.1, S8.2, S8.3, S8.4)
La certeza global de la evidencia fue calificada como muy baja, debido al riesgo de sesgo e imprecisión de los resultados. Desafortunadamente, la evaluación del efecto en la adherencia en los ensayos clínicos controlados identificados no fue factible, ya que no fueron reportados estos datos.
Recomendación: En pacientes con EPOC estable que requieren triple terapia inhalada, ALAT CONSIDERA que no existen diferencias clínicamente significativas al utilizar triple terapia en inhalador único en comparación con el uso de múltiples inhaladores. (Recomendación condicional a favor, certeza de la evidencia baja).
Comentarios del panel: Estudios observacionales han indicado que la SITT podría aumentar la adherencia a la medicación en comparación con la MITT (Material suplementario: Tabla S8.3).82,89–96 La elección entre la SITT y múltiples inhaladores debe considerar los costos, la disponibilidad en cada país y las preferencias del paciente. Es imperativo investigar sobre la costo-efectividad de la terapia triple cerrada o abierta en países latinoamericanos.
Pregunta 9: ¿Qué clasificación de exacerbaciones de EPOC (E-EPOC) tendría un mayor impacto clínico?
Justificación
Las E-EPOC constituyen un evento de considerable relevancia clínica ya que se asocian a un deterioro agudo de la condición clínica, un empeoramiento de la calidad de vida, a mayor utilización y costos de servicios sanitarios, incluyendo hospitalización, mayor riesgo de mortalidad y posterior deterioro de la función respiratoria.
De manera convencional, las exacerbaciones han sido categorizadas según su gravedad, cuantificada en función del nivel más alto asistencial requerido para su manejo. La desventaja de esta clasificación es que, por lo general, no se asigna al momento en el que el paciente accede a la atención clínica.
Recientemente, se propusieron los criterios de Roma,97 desarrollados con la técnica Delphi por expertos, para clasificar la gravedad de una exacerbación, basándose en mediciones clínicas desde el momento de la llegada del paciente. Se espera que la clasificación tenga una buena aceptación, por utilizar variables y algunos puntos de corte reconocidos para la falla respiratoria, además de incorporar mediciones clínicas accesibles, exceptuando la proteína C reactiva (PCR) y la gasometría arterial, aunque estas son mediciones rutinarias en el entorno hospitalario.
Resumen de la evidencia
Se identificaron cinco estudios observacionales en pacientes con EPOC y exacerbación, atendidos en centros de nivel terciario u hospitalario.98–102 Estos evaluaron la clasificación de gravedad de exacerbaciones de la propuesta de Roma, pero sin poder compilar un efecto combinado debido a que utilizaron diferentes estimadores. (Material Suplementario: Tabla S9.1 y S9.2)
Cortés-Tellez et al. evaluaron las dificultades asociadas a la implementación de los criterios de Roma en ciudades situadas a altitud moderada o alta, ya que la disminución de la presión barométrica genera valores basales más bajos de PaO2, SaO2, y PaCO2, las cuales son mediciones que se utilizan para cuantificar la gravedad, pero están fundamentadas en valores obtenidos a nivel del mar. Algo similar se espera por alteraciones crónicas en los niveles de oxigenación o PaCO2, comunes en pacientes con EPOC.
La certeza global de la evidencia fue calificada como muy baja, considerando las características inherentes de estudios observacionales con elevado riesgo de sesgo.
Recomendación: En la evaluación de la gravedad de las E-EPOC, ALAT RECOMIENDA no usar la propuesta de Roma como único instrumento hasta que se obtenga un mayor número de evidencia y validación. (Recomendación condicional en contra, certeza de la evidencia baja).
Comentarios del panel: Son necesarios un mayor número de estudios para determinar si la propuesta de Roma puede discriminar de manera confiable el riesgo de mortalidad a corto plazo. Los criterios de Roma para gravedad de las exacerbaciones requieren validación adicional, especialmente en pacientes residentes en altitudes moderadas a elevadas. También es necesario demostrar que estos criterios ofrecen ventajas en la atención de los pacientes en comparación con los indicadores utilizados actualmente, antes de ser considerados como un instrumento estándar.
Pregunta ١٠: ¿Cuáles medidas no farmacológicas son útiles para lograr la cesación tabáquica en pacientes con EPOC?
Justificación
La cesación tabáquica es la intervención más costo-efectiva para prevenir y detener la progresión de la EPOC, aumentar la supervivencia y reducir la morbilidad asociada. Una proporción importante de pacientes continúa fumando y requieren de apoyo farmacológico y no farmacológico para lograr la cesación.103 Los pacientes con EPOC necesitan mayor apoyo debido a factores como la edad avanzada, mayor consumo de tabaco, grado elevado de dependencia a la nicotina, menor motivación para dejar de fumar y baja autoeficacia.104–106
La estrategia más eficaz para lograr mayor éxito en la cesación tabáquica es la combinación de tratamiento farmacológico y conductual. Sin embargo, en Latinoamérica, en muchos países el acceso a estos fármacos es limitado o inexistente.2 Por consiguiente, es imperativo conocer si solo las intervenciones no farmacológicas, que pueden resultar más accesibles, tienen un efecto beneficioso en pacientes con EPOC.
Resumen de la evidencia
Se identificaron seis estudios aleatorizados,107–112 con un total de 4.411 pacientes, los cuales evaluaron programas de cesación tabáquica no farmacológica individual, comparado con manejo habitual o no intervención en pacientes fumadores con EPOC. Se evaluaron los programas de cesación tabáquica no farmacológica individual que incluían consejería individual o grupal con o sin intervenciones conductuales. Se consideró el uso de material informativo complementario con instrucciones escritas en folletos o manuales, además de llamadas o mensajes recordatorios. El grupo control recibió una única sesión de consejería breve o manejo habitual. Se excluyeron los estudios que incluyeron intervenciones farmacológicas. (Material suplementario: Tablas S10.1 y S10.2).
En comparación con el tratamiento habitual o consejería breve, es probable que los programas de cesación tabáquica no farmacológica individual incrementen la tasa de abstinencia, con certeza de la evidencia moderada. Adicionalmente, podrían asociarse a una menor mortalidad; sin embargo, existe considerable incertidumbre dado que la certeza de la evidencia es muy baja. (Material suplementario: Figuras S10.1 y S10.2)
Recomendación: En pacientes con EPOC, ALAT CONSIDERA que las medidas no farmacológicas favorecen la cesación tabáquica (Recomendación condicional a favor, certeza de la evidencia moderada), pero han demostrado mínimo efecto sobre la mortalidad. (Recomendación condicional a favor, certeza de la evidencia muy baja)
Comentarios del panel: En pacientes con EPOC, es fundamental enfatizar en las estrategias no farmacológicas de cesación tabáquica para aumentar la abstención tabáquica. Sin embargo, se requieren nuevos estudios para valorar su efecto en otros desenlaces clínicos (reducción de exacerbaciones, hospitalizaciones, mortalidad y costo-eficiencia). Asimismo, es imperativo continuar promoviendo la prohibición de la venta y uso de todas las formas de nicotina en la región, dado que favorecen la adicción a la nicotina, y constituye la estrategia más rentable para prevenir y tratar las enfermedades asociadas al tabaquismo y vapeo. Si hay acceso a tratamiento farmacológico, este debe combinarse con el no farmacológico.
Preguntas ١١ y ١٢.
¿Cuál es el impacto clínico de la terapia broncodilatadora prolongada (en comparación con la terapia broncodilatadora de corta acción) en pacientes con EPOC no tabáquico en Latinoamérica?
¿Cuál es el impacto clínico de la terapia con corticoides inhalados (CI) asociada a terapia broncodilatadora inhalatoria prolongada asociada (LABA + LAMA + ICS) en comparación con terapia broncodilatadora inhalatoria prolongada asociada inhalatoria (LABA + LAMA) en pacientes con EPOC no tabáquico?
Justificación
La epidemiología de EPOC en no fumadores, definidos como personas que fumaron menos de 100 cigarrillos en la vida, es muy variable, influenciada por factores sociodemográficos, poblacionales y los métodos diagnósticos utilizados en los estudios de cada región. Es relevante señalar que la falta o subutilización de la espirometría puede resultar en subestimaciones de la prevalencia de la enfermedad. La prevalencia de EPOC en no fumadores en estudios poblacionales, que utilizaron definición espirométrica, incluidos estudios en LA,3,113,114 varía entre 4 a 16%. En pacientes con EPOC, representa entre el 21-51% y hasta un 66% de los DALYs.4,115 Latinoamérica es heterogénea en su nivel socioeconómico, geográfico, cultural y en la provisión de servicios sanitarios, con múltiples factores de riesgo para el desarrollo de EPOC en no fumadores. Su curso clínico, radiológico y los marcadores inflamatorios difieren de aquellos del EPOC en fumadores.116–123 Después del tabaquismo, la exposición más estudiada en LA es la ambiental tanto intra como extra domiciliaria. Sin embargo, aunque la prevalencia de infecciones respiratorias en la infancia,124 tuberculosis125–127 y VIH128 es significativa, estas han sido menos estudiadas como factor de riesgo para EPOC.
Si bien las normativas actuales ofrecen una estructura para intervenciones efectivas en el diagnóstico y manejo, la evidencia científica que respalda la efectividad de tratamientos específicos para el EPOC en no fumadores es limitada, dado que esta población ha sido excluida de los estudios clínicos. Además, la implementación de protocolos específicos debe considerar los recursos disponibles y la costo-efectividad de estas intervenciones en cada país.
Estas preguntas son relevantes dado que en Latinoamérica es probable que el porcentaje de EPOC en no fumadores supere al de EPOC en fumadores. Al analizar los estudios epidemiológicos en EPOC por exposición a biomasa,117–119,129,130 se observa que los pacientes reciben broncodilatadores tanto de acción corta como de prolongada, aunque se desconoce cuál es el efecto en los desenlaces clínicos.
Resumen de la evidencia
Al momento del corte de búsqueda de evidencia, no se logró obtener información para contestar las preguntas PICO establecidas. Posteriormente, Ramírez-Venegas et al. publicaron el único estudio de seis meses de duración que compara desenlaces clínicos del uso de LABA/LAMA vs. LABA/ICS en pacientes con EPOC por biomasa (n= 31 y 33, respectivamente) y EPOC en fumadores (n=34 y 34, respectivamente). Los pacientes tenían historia de dos exacerbaciones moderadas en el año previo. El estudio no demostró diferencias en exacerbaciones, síntomas, función pulmonar y calidad de vida entre los dos tratamientos, ni entre los distintos tipos de EPOC, incluso en pacientes con historia de asma o eosinofilia ≥ 300 cel·mm−3.131
Recomendación: Ante la falta de datos específicos y el único estudio piloto en EPOC-Biomasa, ALAT RECOMIENDA tratar la EPOC en no fumadores siguiendo las normativas del EPOC en fumadores, excepto en casos postuberculosis con obstrucción, donde el uso de esteroides inhalados no es aconsejable por el riesgo de reactivación de la tuberculosis.132–135
Comentarios del panel: Para poder contestar estas preguntas, el Departamento de EPOC de ALAT ha emprendido un proyecto de investigación multicéntrico destinado a evaluar la prevalencia de EPOC en no fumadores y su manejo en Latinoamérica. Este proyecto está en curso y se espera obtener resultados a la brevedad para establecer las recomendaciones sobre el manejo de los pacientes conforme al etiotipo de EPOC.
Conclusiones
El objetivo de responder preguntas que surgen en el día a día de la valoración de pacientes con EPOC es proporcionar recomendaciones de relevancia para Latinoamérica, basadas en cuestionamientos planteados no sólo por los integrantes del departamento de EPOC de ALAT, sino también por los representantes de las sociedades Nacionales de Neumología. Se consideran relevantes para médicos neumólogos, internistas, médicos familiares, generales, salubristas, así como aquellos que participan en la toma de decisiones en el ámbito sanitario para el desarrollo de programas aplicables a nivel local, nacional o latinoamericano, orientados al diagnóstico y tratamiento de la EPOC, teniendo como objetivo reducir la carga asistencial y los costos asociados a la enfermedad.
El Departamento de EPOC y las sociedades nacionales miembros de ALAT reconocen la importancia de adherirse a las normativas internacionales para el diagnóstico y manejo de EPOC en fumadores. Sin embargo, reconocen la limitada aplicabilidad de estas normativas en la mayoría de los países de la región, debido a la heterogeneidad socio-geográfica y cultural de Latinoamérica, lo que dificulta el acceso y continuidad del tratamiento recomendado. En consonancia con lo anterior, aunque se planteó la interrogante de analizar las nuevas terapias emergentes (biológicos,136–138 ensifentrine,139,140 broncoscópicos,141–143 etc), estas no se consideraron apropiadas para la presente guía, debido a las limitaciones de acceso y el poder adquisitivo en la región.
Muchas de las interrogantes planteadas por los expertos participantes parecen sencillas, sin embargo, son muy relevantes para el manejo de la EPOC en nuestra región. Por primera vez, las recomendaciones proporcionadas han sido evaluadas con criterios estrictos de la metodología GRADE y ha quedado en evidencia la escasez o ausencia de información disponible para responder las preguntas. Aquellas que cuentan con evidencia son de baja o muy baja calidad, debido a la heterogeneidad de los datos disponibles. En consecuencia, varias de las preguntas fueron respondidas con la información disponible en forma narrativa, o bien, a través de las opiniones de los participantes en el panel de expertos.
Indudablemente, estos son temas relevantes para futuras investigaciones, especialmente en el contexto de nuestro entorno y para países de bajos y medianos recursos.
Financiamiento: los autores declaran que se recibió financiamiento de GSK y Chiesi México para realizar este trabajo.
Conflictos de interés: DT: Recibió honorarios de ALAT como coordinador del grupo de trabajo de este manuscrito. JPV: Recibió honorarios por parte de ALAT como asesor metodológico de este manuscrito durante el año 2024. MC: recibió apoyo financiero para viajes a Congresos Internacionales, para dar charlas y para consultorías de parte de las empresas AstraZeneca, GKK, BI, Pfizer. Los otros autores declaran que no tienen conflictos de interés con relación al tema de este manuscrito.
Contribuciones de los autores: LM: administración del proyecto, conceptualización, escritura, revisión y edición, redacción borrador original. ESA: administración del proyecto, conceptualización, escritura, revisión y edición, redacción borrador original, visualización. DT: análisis formal, investigación, metodología, escritura, revisión y edición, redacción borrador original. JPV: análisis formal, investigación, metodología, escritura, revisión y edición, redacción borrador original. MC: escritura, revisión y edición, redacción borrador original. RPP: conceptualización, escritura, revisión y edición, redacción borrador original.
El Editor en Jefe, Dr. Francisco Arancibia, realizó el seguimiento del proceso de revisión y aprobó este artículo.
Tabla 1.
Resumen Recomendaciones ALAT para el diagnóstico y tratamiento de la EPOC en América Latina
|
Pregunta PICO |
Recomendación final |
|
Pregunta 1: ¿Cuál es el impacto clínico de la educación individual en inhaloterapia comparada con el cuidado habitual en los pacientes con EPOC? |
En pacientes con EPOC, ALAT RECOMIENDA realizar educación individual en inhaloterapia comparado con no realizarla. (Recomendación condicional a favor, certeza de la evidencia baja) |
|
Pregunta 2: ¿Cuál es el impacto clínico del incentivo de la actividad física (AF) comparado con el cuidado habitual en los pacientes con EPOC? |
En pacientes con EPOC, ALAT RECOMIENDA la implementación de programas de incentivo de la AF en combinación con el cuidado habitual, comparado con realizar solo cuidado habitual. (Recomendación condicional a favor, certeza de la evidencia baja). |
|
Pregunta 3: ¿Cuál es el impacto clínico del entrenamiento de músculos inspiratorios (EMI) comparado con el cuidado habitual en los pacientes con EPOC? |
En pacientes con EPOC, ALAT RECOMIENDA no incorporar el entrenamiento de músculos inspiratorios de forma rutinaria de forma aislada al cuidado habitual sino en conjunto a un programa de rehabilitación respiratoria (Recomendación condicional en contra, certeza de la evidencia baja). |
|
Pregunta 4: ¿Cuál es el riesgo para desarrollar EPOC en fumadores con espirometría anormal no obstructiva (patrón PRISm) en comparación con fumadores con espirometría normal?
|
ALAT CONSIDERA que en individuos fumadores con espirometría anormal no obstructiva (patrón PRISm) existe un incremento en la incidencia de EPOC en comparación con aquellos fumadores con espirometría normal. (Recomendación condicional a favor, certeza de la evidencia muy baja). |
|
Pregunta 5: ¿Cuál es el riesgo de hospitalizar y de morir en pacientes con EPOC tabáquico que continúan fumando en comparación con los que dejan de fumar? |
En pacientes con EPOC, ALAT CONSIDERA que el tabaquismo activo aumenta el riesgo de hospitalización y de mortalidad, por causa respiratoria y por todas las causas (Recomendación condicional a favor, certeza de la evidencia muy baja) |
|
Pregunta 6: ¿Cuál es la efectividad clínica de la terapia broncodilatadora en pacientes con EPOC que siguen fumando?
|
En pacientes con EPOC que reciben tratamiento con broncodilatadores y que continúan fumando, ALAT CONSIDERA que tanto el cambio de los valores absolutos del VEF1, como su declinación parecen descender de forma más acelerada en aquellos que continúan fumando, comparado con aquellos exfumadores, a pesar de la terapia broncodilatadora (Recomendación condicional a favor, certeza de la evidencia muy baja). |
|
Pregunta 7: ¿Cuáles son los pacientes con EPOC que al recibir oxigenoterapia domiciliaria presentan reducción de mortalidad? |
En pacientes con EPOC e hipoxemia grave, ALAT RECOMIENDA el uso de oxígeno suplementario al menos durante 15 horas diarias, en lugar de no usarlo. (Recomendación condicional a favor, certeza de la evidencia baja); En caso de hipoxemia moderada (PaO2>55 mmHg) sin evidencias de policitemia o hipertensión pulmonar, ALAT RECOMIENDA no usar oxígeno domiciliario suplementario a largo plazo. (Recomendación condicional a favor, certeza de la evidencia baja) |
|
Pregunta 8: ¿Hay diferencias en el riesgo de hospitalizar y de morir entre la triple terapia abierta versus cerrada en pacientes con EPOC estable?
|
En pacientes con EPOC estable que requieren triple terapia inhalada, ALAT CONSIDERA que no existen diferencias clínicamente significativas al utilizar triple terapia en inhalador único en comparación con el uso de múltiples inhaladores. (Recomendación condicional a favor, certeza de la evidencia baja). |
|
Pregunta 9: ¿Qué clasificación de exacerbaciones de EPOC (E-EPOC) tendría un mayor impacto clínico?
|
En la evaluación de la gravedad de las E-EPOC, ALAT RECOMIENDA no usar la propuesta de Roma como único instrumento hasta que se obtenga un mayor número de evidencia y validación (Recomendación condicional en contra, certeza de la evidencia baja). |
|
Pregunta 10: ¿Cuáles medidas no farmacológicas son útiles para lograr la cesación tabáquica en pacientes con EPOC?
|
En pacientes con EPOC, ALAT CONSIDERA que las medidas no farmacológicas favorecen la cesación tabáquica (Recomendación condicional a favor, certeza de la evidencia moderada), pero han demostrado mínimo efecto sobre la mortalidad. (Recomendación condicional a favor, certeza de la evidencia muy baja). |
|
Preguntas 11 y 12: ¿Cuál es el impacto clínico de la terapia broncodilatadora prolongada (en comparación con la terapia broncodilatadora de corta acción) en pacientes con EPOC no relacionado a tabaco en Latinoamérica? ¿Cuál es el impacto clínico de la terapia con corticoides inhalados (CI) asociada a terapia broncodilatadora inhalatoria prolongada asociada (LABA + LAMA + ICS) en comparación con terapia broncodilatadora inhalatoria prolongada asociada inhalatoria (LABA + LAMA) en pacientes con EPOC no tabáquico? |
— No se logró obtener evidencia para contestar estas preguntas PICO establecidas por el grupo de expertos. — Ante la falta de datos específicos y el único estudio piloto en EPOC-Biomasa, ALAT RECOMIENDA tratar la EPOC en no fumadores siguiendo las normativas del EPOC en fumadores, excepto en casos postuberculosis con obstrucción, donde el uso de esteroides inhalados no es aconsejable por el riesgo de reactivación de la tuberculosis. |
Referencias
1. Stolz D, Mkorombindo T, Schumann DM et al. Towards the elimination of chronic obstructive pulmonary disease: a Lancet Commission. Lancet Lond Engl 2022;400(10356):921-72. https://doi.org/10.1016/S0140-6736(22)01273-9
2. Polverino F, Bhutani M, Zabert G et al. Access to Treatment for Chronic Obstructive Pulmonary Disease in the Americas: A Call for Action. A Joint Perspective from the Brazilian Thoracic Society, Canadian Thoracic Society, Latin American Thoracic Society, and the American Thoracic Society. Ann Am Thorac Soc 2024;21(11):1463-70. https://doi.org/10.1513/AnnalsATS.202404-386FR
3. Torres-Duque CA, Jaramillo C, Caballero A et al. Chronic obstructive pulmonary disease related to wood smoke and impact of the combined exposure to tobacco. IJTLD Open 2024;1(3):130-5. https://doi.org/10.5588/ijtldopen.24.0004
4. Yang IA, Jenkins CR, Salvi SS. Chronic obstructive pulmonary disease in never-smokers: risk factors, pathogenesis, and implications for prevention and treatment. Lancet Respir Med 2022;10(5):497-511. https://doi.org/10.1016/S2213-2600(21)00506-3
5. Joo H, Yoon HK, Hwang YI et al. Application of the Lancet Commission COPD classification to COPD Cohort Population in South Korea. Respir Med 2024;230:107679. https://doi.org/10.1016/j.rmed.2024.107679
6. Schünemann HJ, Wiercioch W, Etxeandia I et al. Guidelines 2.0: systematic development of a comprehensive checklist for a successful guideline enterprise. CMAJ 2014;186(3):E123-142. https://doi.org/10.1503/cmaj.131237
7. Alonso-Coello P, Schünemann HJ, Moberg J et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 1: Introduction. BMJ 2016;353:i2016. https://doi.org/10.1136/bmj.i2016
8. Alonso-Coello P, Oxman AD, Moberg J et al. GRADE Evidence to Decision (EtD) frameworks: a systematic and transparent approach to making well informed healthcare choices. 2: Clinical practice guidelines. BMJ 2016;353:i2089. https://doi.org/10.1136/bmj.i2089
9. Guyatt G, Oxman AD, Akl EA et al. GRADE guidelines: 1. Introduction-GRADE evidence profiles and summary of findings tables. J Clin Epidemiol 2011;64(4):383-94. https://doi.org/10.1016/j.jclinepi.2010.04.026
10. Guyatt GH, Oxman AD, Vist GE et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ 2008;336(7650):924-6. https://doi.org/10.1136/bmj.39489.470347.AD
11. Schünemann HJ, Mustafa R, Brozek J et al. GRADE Guidelines: 16. GRADE evidence to decision frameworks for tests in clinical practice and public health. J Clin Epidemiol 2016;76:89-98. https://doi.org/10.1016/j.jclinepi.2016.01.032
12. Institute of Medicine (US) Committee on Standards for Developing Trustworthy Clinical Practice Guidelines; Editors: Graham R, Mancher M, Miller Wolman D, et al. Clinical Practice Guidelines We Can Trust. National Academies Press (US), Washington (DC), 2011.
13. Freites-Martinez A, Santana N, Arias-Santiago S et al. Using the Common Terminology Criteria for Adverse Events (CTCAE - Version 5.0) to Evaluate the Severity of Adverse Events of Anticancer Therapies. Actas Dermosifiliogr 2021;112(1):90-2. https://doi.org/10.1016/j.ad.2019.05.009
14. Kirmayr M, Quilodrán C, Valente B et al. The GRADE approach, Part 1: how to assess the certainty of the evidence. Medwave 2021;21(2):e8109. https://doi.org/10.5867/medwave.2021.02.8109
15. Khdour MR, Kidney JC, Smyth BM et al. Clinical pharmacy-led disease and medicine management programme for patients with COPD. Br J Clin Pharmacol 2009;68(4):588-98. https://doi.org/10.1111/j.1365-2125.2009.03493.x
16. Rootmensen GN, van Keimpema ARJ, Looysen EE et al. The effects of additional care by a pulmonary nurse for asthma and COPD patients at a respiratory outpatient clinic: results from a double blind, randomized clinical trial. Patient Educ Couns 2008;70(2):179-86. https://doi.org/10.1016/j.pec.2007.09.021
17. Xin C, Xia Z, Jiang C et al. The impact of pharmacist-managed clinic on medication adherence and health-related quality of life in patients with COPD: a randomized controlled study. Patient Prefer Adherence 2016;10:1197-203. https://doi.org/10.2147/PPA.S110167
18. Tommelein E, Mehuys E, Van Hees T et al. Effectiveness of pharmaceutical care for patients with chronic obstructive pulmonary disease (PHARMACOP): a randomized controlled trial. Br J Clin Pharmacol 2014;77(5):756-66. https://doi.org/10.1111/bcp.12242
19. Göriş S, Taşci S, Elmali F. The effects of training on inhaler technique and quality of life in patients with COPD. J Aerosol Med Pulm Drug Deliv 2013;26(6):336-44. https://doi.org/10.1089/jamp.2012.1017
20. Bosnic-Anticevich SZ, Sinha H, So S et al. Metered-dose inhaler technique: the effect of two educational interventions delivered in community pharmacy over time. J Asthma 2010;47(3):251-6. https://doi.org/10.3109/02770900903580843
21. van der Palen J, Klein JJ, Kerkhoff AH et al. Evaluation of the long-term effectiveness of three instruction modes for inhaling medicines. Patient Educ Couns 1997;32(1):S87-95. https://doi.org/10.1016/s0738-3991(97)00100-6
22. De Blaquiere P, Christensen DB, Carter WB et al. Use and misuse of metered-dose inhalers by patients with chronic lung disease. A controlled, randomized trial of two instruction methods. Am Rev Respir Dis 1989;140(4):910-6. https://doi.org/10.1164/ajrccm/140.4.910
23. Pitta F, Troosters T, Spruit MA et al. Characteristics of physical activities in daily life in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2005;171(9):972-7. https://doi.org/10.1164/rccm.200407-855OC
24. Watz H, Waschki B, Meyer T et al. Physical activity in patients with COPD. Eur Respir J 2009;33(2):262-72. https://doi.org/10.1183/09031936.00024608
25. Mendoza L, de Oca MM, López Varela MV et al. Physical Activity Levels and Associated Factors in a Latin American COPD Population of Patients. The LASSYC Study. COPD 2021;18(4):393-400. https://doi.org/10.1080/15412555.2021.1937090
26. Waschki B, Kirsten A, Holz O et al. Physical activity is the strongest predictor of all-cause mortality in patients with COPD: a prospective cohort study. Chest 2011;140(2):331-42. https://doi.org/10.1378/chest.10-2521
27. Parada A, Klaassen J, Lisboa C et al. [Reduction of physical activity in patients with chronic obstructive pulmonary disease]. Rev Med Chil 2011;139(12):1562-72. http://dx.doi.org/10.4067/S0034-98872011001200005
28. Esteban C, Quintana JM, Aburto M et al. Impact of changes in physical activity on health-related quality of life among patients with COPD. Eur Respir J 2010;36(2):292-300. https://doi.org/10.1183/09031936.00021409
29. Shrikrishna D, Patel M, Tanner RJ et al. Quadriceps wasting and physical inactivity in patients with COPD. Eur Respir J 2012;40(5):1115-22. https://doi.org/10.1183/09031936.00170111
30. Wootton SL, Hill K, Alison JA et al. Effects of ground-based walking training on daily physical activity in people with COPD: A randomised controlled trial. Respir Med 2017;132:139-45. https://doi.org/10.1016/j.rmed.2017.10.008
31. Hospes G, Bossenbroek L, Ten Hacken NHT et al. Enhancement of daily physical activity increases physical fitness of outclinic COPD patients: results of an exercise counseling program. Patient Educ Couns 2009;75(2):274-8. https://doi.org/10.1016/j.pec.2008.10.005
32. Arbillaga-Etxarri A, Gimeno-Santos E, Barberan-Garcia A et al. Long-term efficacy and effectiveness of a behavioural and community-based exercise intervention (Urban Training) to increase physical activity in patients with COPD: a randomised controlled trial. Eur Respir J 2018;52(4):1800063. https://doi.org/10.1183/13993003.00063-2018
33. Vorrink SNW, Kort HSM, Troosters T et al. Efficacy of an mHealth intervention to stimulate physical activity in COPD patients after pulmonary rehabilitation. Eur Respir J 2016;48(4):1019-29. https://doi.org/10.1183/13993003.00083-2016
34. Mendoza L, Horta P, Espinoza J et al. Pedometers to enhance physical activity in COPD: a randomised controlled trial. Eur Respir J 2015;45(2):347-54. https://doi.org/10.1183/09031936.00084514
35. Demeyer H, Louvaris Z, Frei A et al. Physical activity is increased by a 12-week semiautomated telecoaching programme in patients with COPD: a multicentre randomised controlled trial. Thorax 2017;72(5):415-23. https://doi.org/10.1136/thoraxjnl-2016-209026
36. Pleguezuelos E, Pérez ME, Guirao L et al. Improving physical activity in patients with COPD with urban walking circuits. Respir Med 2013;107(12):1948-56. https://doi.org/10.1016/j.rmed.2013.07.008
37. Lisboa C, Borzone G, Cruz E. [Inspiratory muscle training in patients with chronic obstructive pulmonary disease]. Rev Med Chil 1998;126(5):563-8.
38. Leiva LE, Lammie PJ. Modulation of lymphocyte activation by soluble Brugia pahangi extracts. Trop Med Parasitol 1989;40(3):327-31.
39. Similowski T, Yan S, Gauthier AP et al. Contractile properties of the human diaphragm during chronic hyperinflation. N Engl J Med 1991;325(13):917-23. https://doi.org/10.1056/NEJM199109263251304
40. Ammous O, Feki W, Lotfi T et al. Inspiratory muscle training, with or without concomitant pulmonary rehabilitation, for chronic obstructive pulmonary disease (COPD). Cochrane Database Syst Rev 2023;1(1):CD013778. https://doi.org/10.1002/14651858.CD013778.pub2
41. Young KA, Strand M, Ragland MF et al. Pulmonary Subtypes Exhibit Differential Global Initiative for Chronic Obstructive Lung Disease Spirometry Stage Progression: The COPDGene® Study. Chronic Obstr Pulm Dis 2019;6(5):414-29. https://doi.org/10.15326/jcopdf.6.5.2019.0155
42. Wijnant SRA, De Roos E, Kavousi M et al. Trajectory and mortality of preserved ratio impaired spirometry: the Rotterdam Study. Eur Respir J 2020;55(1):1901217. https://doi.org/10.1183/13993003.01217-2019
43. Perez-Padilla R, Montes de Oca M, Thirion-Romero I et al. Trajectories of Spirometric Patterns, Obstructive and PRISm, in a Population-Based Cohort in Latin America. Int J Chron Obstruct Pulmon Dis 2023;18:1277-85. https://doi.org/10.2147/COPD.S406208
44. Park HJ, Byun MK, Rhee CK et al. Significant predictors of medically diagnosed chronic obstructive pulmonary disease in patients with preserved ratio impaired spirometry: a 3-year cohort study. Respir Res 2018;19(1):185. https://doi.org/10.1186/s12931-018-0896-7
45. Hersh CP, DeMeo DL, Al-Ansari E et al. Predictors of survival in severe, early onset COPD. Chest 2004;126(5):1443-51. https://doi.org/10.1378/chest.126.5.1443
46. Anthonisen NR, Skeans MA, Wise RA et al. The effects of a smoking cessation intervention on 14.5-year mortality: a randomized clinical trial. Ann Intern Med 2005;142(4):233-9. https://doi.org/10.7326/0003-4819-142-4-200502150-00005
47. Li X, Wu Z, Xue M et al. Smoking status affects clinical characteristics and disease course of acute exacerbation of chronic obstructive pulmonary disease: A prospectively observational study. Chron Respir Dis 2020;17:1479973120916184. https://doi.org/10.1177/1479973120916184
48. Kang HR, Kim SJ, Nam JG et al. Impact of Smoking and Chronic Obstructive Pulmonary Disease on All-Cause, Respiratory, and Cardio-Cerebrovascular Mortality. Int J Chron Obstruct Pulmon Dis 2024;19:1261-72. https://doi.org/10.2147/COPD.S458356
49. Montes de Oca M, Laucho-Contreras ME. Smoking cessation and vaccination. Eur Respir Rev Off J Eur Respir Soc 2023;32(167):220187. https://doi.org/10.1183/16000617.0187-2022
50. Anthonisen NR, Connett JE, Kiley JP et al. Effects of smoking intervention and the use of an inhaled anticholinergic bronchodilator on the rate of decline of FEV1. The Lung Health Study. JAMA 1994;272(19):1497-505. https://doi.org/10.1001/jama.1994.03520190043033
51. Tashkin DP, Celli B, Kesten S et al. Long-term efficacy of tiotropium in relation to smoking status in the UPLIFT trial. Eur Respir J 2010;35(2):287-94. https://doi.org/10.1183/09031936.00082909
52. Tashkin DP, Goodin T, Bowling A et al. Effect of smoking status on lung function, patient-reported outcomes, and safety among COPD patients treated with glycopyrrolate inhalation powder: pooled analysis of GEM1 and GEM2 studies. Respir Res 2019;20(1):135. https://doi.org/10.1186/s12931-019-1112-0
53. Calverley PMA, Anderson JA, Brook RD et al. Fluticasone Furoate, Vilanterol, and Lung Function Decline in Patients with Moderate Chronic Obstructive Pulmonary Disease and Heightened Cardiovascular Risk. Am J Respir Crit Care Med 2018;197(1):47-55. https://doi.org/10.1164/rccm.201610-2086OC
54. Pauwels RA, Löfdahl CG, Laitinen LA et al. Long-term treatment with inhaled budesonide in persons with mild chronic obstructive pulmonary disease who continue smoking. European Respiratory Society Study on Chronic Obstructive Pulmonary Disease. N Engl J Med 1999;340(25):1948-53. https://doi.org/10.1056/NEJM199906243402503
55. Nocturnal Oxygen Therapy Trial Group. Continuous or nocturnal oxygen therapy in hypoxemic chronic obstructive lung disease: a clinical trial. Ann Intern Med 1980;93(3):391-8. https://doi.org/10.7326/0003-4819-93-3-391
56. Report of the Medical Research Council Working Party. Long term domiciliary oxygen therapy in chronic hypoxic cor pulmonale complicating chronic bronchitis and emphysema. Lancet Lond Engl 1981;1(8222):681-6. https://doi.org/10.1016/S0140-6736(81)91970-X
57. Magnet FS, Storre JH, Windisch W. Home oxygen therapy: evidence versus reality. Expert Rev Respir Med 2017;11(6):425-41. https://doi.org/10.1080/17476348.2017.1325323
58. Jacobs SS, Krishnan JA, Lederer DJ et al. Home Oxygen Therapy for Adults with Chronic Lung Disease. An Official American Thoracic Society Clinical Practice Guideline. Am J Respir Crit Care Med 2020;202(10):e121-41. https://doi.org/10.1164/rccm.202009-3608ST
59. McDonald CF, Serginson J, AlShareef S et al. Thoracic Society of Australia and New Zealand clinical practice guideline on adult home oxygen therapy. Respirol Carlton Vic 2024;29(9):765-84. https://doi.org/10.1111/resp.14793
60. Hardinge M, Annandale J, Bourne S et al. British Thoracic Society guidelines for home oxygen use in adults. Thorax 2015;70(Suppl 1):i1-43. https://doi.org/10.1136/thoraxjnl-2015-206865
61. Fletcher EC, Luckett RA, Goodnight-White S et al. A double-blind trial of nocturnal supplemental oxygen for sleep desaturation in patients with chronic obstructive pulmonary disease and a daytime PaO2 above 60 mm Hg. Am Rev Respir Dis 1992;145(5):1070-6. https://doi.org/10.1164/ajrccm/145.5.1070
62. Chaouat A, Weitzenblum E, Kessler R et al. A randomized trial of nocturnal oxygen therapy in chronic obstructive pulmonary disease patients. Eur Respir J 1999;14(5):1002-8. https://doi.org/10.1183/09031936.99.14510029
63. Górecka D, Gorzelak K, Sliwiński P et al. Effect of long-term oxygen therapy on survival in patients with chronic obstructive pulmonary disease with moderate hypoxaemia. Thorax 1997;52(8):674-9. https://doi.org/10.1136/thx.52.8.674
64. Moore RP, Berlowitz DJ, Denehy L et al. A randomised trial of domiciliary, ambulatory oxygen in patients with COPD and dyspnoea but without resting hypoxaemia. Thorax 2011;66(1):32-7. https://doi.org/10.1136/thx.2009.132522
65. Albert RK, Au DH, et al.; Long-Term Oxygen Treatment Trial Research Group. A Randomized Trial of Long-Term Oxygen for COPD with Moderate Desaturation. N Engl J Med 2016;375(17):1617-27. https://doi.org/10.1056/NEJMoa1604344
66. Ringbaek T, Martinez G, Lange P. The long-term effect of ambulatory oxygen in normoxaemic COPD patients: a randomised study. Chron Respir Dis 2013;10(2):77-84. https://doi.org/10.1177/1479972312473135
67. Lacasse Y, Sériès F, Corbeil F et al. Randomized Trial of Nocturnal Oxygen in Chronic Obstructive Pulmonary Disease. N Engl J Med 2020;383(12):1129-38. https://doi.org/10.1056/NEJMoa2013219
68. Sun L, Chang YF, Wang YF et al. Prognostic value of oxygen inhalation therapy for simple nocturnal hypoxemia in COPD: a meta-analysis. Front Pharmacol 2023;14:1123945. https://doi.org/10.3389/fphar.2023.1123945
69. Ekström M, Andersson A, Papadopoulos S et al. Long-Term Oxygen Therapy for 24 or 15 Hours per Day in Severe Hypoxemia. N Engl J Med 2024;391(11):977-88. https://doi.org/10.1056/NEJMoa2402638
70. McDonald CF, Blyth CM, Lazarus MD et al. Exertional oxygen of limited benefit in patients with chronic obstructive pulmonary disease and mild hypoxemia. Am J Respir Crit Care Med 1995;152(5 Pt 1):1616-9. https://doi.org/10.1164/ajrccm.152.5.7582304
71. Ejiofor SI, Bayliss S, Gassamma A et al. Ambulatory Oxygen for Exercise-Induced Desaturation and Dyspnea in Chronic Obstructive Pulmonary Disease (COPD): Systematic Review and Meta-Analysis. Chronic Obstr Pulm Dis 2016;3(1):419-34. https://doi.org/10.15326/jcopdf.3.1.2015.0146
72. Ameer F, Carson KV, Usmani ZA et al. Ambulatory oxygen for people with chronic obstructive pulmonary disease who are not hypoxaemic at rest. Cochrane Database Syst Rev 2014;2014(6):CD000238. https://doi.org/10.1002/14651858.CD000238.pub2
73. Hasegawa T, Ochi T, Goya S et al. Efficacy of supplemental oxygen for dyspnea relief in patients with advanced progressive illness: A systematic review and meta-analysis. Respir Investig 2023;61(4):418-37. https://doi.org/10.1016/j.resinv.2023.03.005
74. Khor YH, Wong R, McDonald CF. Post-Hospitalization Short-Term Oxygen Therapy: Use of a Clinical Management Pathway and Long-Term Follow-Up. Respir Care 2019;64(3):272-8. https://doi.org/10.4187/respcare.06303
75. Oba Y, Salzman GA, Willsie SK. Reevaluation of continuous oxygen therapy after initial prescription in patients with chronic obstructive pulmonary disease. Respir Care 2000;45(4):401-6.
76. Wiener RS, Ouellette DR, Diamond E et al. An official American Thoracic Society/American College of Chest Physicians policy statement: the Choosing Wisely top five list in adult pulmonary medicine. Chest 2014;145(6):1383-91. https://doi.org/10.1378/chest.14-0670
77. Montes de Oca M, López Varela MV, Acuña A et al. Incorporating New Evidence on Inhaled Medications in COPD. The Latin American Chest Association (ALAT) 2019. Arch Bronconeumol 2020;56(2):106-13. https://doi.org/10.1016/j.arbres.2019.09.023
78. Chapman KR, Ringdal N, Backer V et al. Salmeterol and fluticasone propionate (50/250 microg) administered via combination Diskus inhaler: as effective as when given via separate Diskus inhalers. Can Respir J 1999;6(1):45-51. https://doi.org/10.1155/1999/894803
79. López-Campos JL, Carrasco-Hernández L, Román Rodríguez L et al. The clinical implications of triple therapy in fixed-dose combination in COPD: from the trial to the patient. Arch Bronconeumol 2020;56(4):242-8. https://doi.org/10.1016/j.arbr.2020.02.002
80. Sposato B, Ricci A, Lacerenza LG et al. Triple Therapy in COPD in Real Life: Is It Better to Use Single or Multiple Inhalers? J Clin Med 2024;13(20):6191. https://doi.org/10.3390/jcm13206191
81. Zhang S, King D, Rosen VM et al. Impact of Single Combination Inhaler versus Multiple Inhalers to Deliver the Same Medications for Patients with Asthma or COPD: A Systematic Literature Review. Int J Chron Obstruct Pulmon Dis 2020;15:417-38. https://doi.org/10.2147/COPD.S234823
82. Halpin DMG, Rothnie KJ, Banks V et al. Comparative Adherence and Persistence of Single- and Multiple-Inhaler Triple Therapies Among Patients with Chronic Obstructive Pulmonary Disease in an English Real-World Primary Care Setting. Int J Chron Obstruct Pulmon Dis 2022;17:2417-29. https://doi.org/10.2147/COPD.S370540
83. Bremner PR, Birk R, Brealey N et al. Single-inhaler fluticasone furoate/umeclidinium/vilanterol versus fluticasone furoate/vilanterol plus umeclidinium using two inhalers for chronic obstructive pulmonary disease: a randomized non-inferiority study. Respir Res 2018;19(1):19. https://doi.org/10.1186/s12931-018-0724-0
84. Ferguson GT, Brown N, Compton C et al. Once-daily single-inhaler versus twice-daily multiple-inhaler triple therapy in patients with COPD: lung function and health status results from two replicate randomized controlled trials. Respir Res 2020;21(1):131. https://doi.org/10.1186/s12931-020-01360-w
85. Ferguson GT, Rabe KF, Martinez FJ et al. Triple therapy with budesonide/glycopyrrolate/formoterol fumarate with co-suspension delivery technology versus dual therapies in chronic obstructive pulmonary disease (KRONOS): a double-blind, parallel-group, multicentre, phase 3 randomised controlled trial. Lancet Respir Med 2018;6(10):747-58. https://doi.org/10.1016/S2213-2600(18)30327-8
86. Halpin DMG, Worsley S, Ismaila AS et al. INTREPID: single- versus multiple-inhaler triple therapy for COPD in usual clinical practice. ERJ Open Res 2021;7(2):00950-2020. https://doi.org/10.1183/23120541.00950-2020
87. Salvi S, Balki A, Krishnamurthy S et al. Efficacy and safety of single-inhaler triple therapy of glycopyrronium, formoterol and fluticasone in patients with COPD: a double-blind, randomised controlled trial. ERJ Open Res 2021;7(3):00255-2021. https://doi.org/10.1183/23120541.00255-2021
88. Vestbo J, Papi A, Corradi M et al. Single inhaler extrafine triple therapy versus long-acting muscarinic antagonist therapy for chronic obstructive pulmonary disease (TRINITY): a double-blind, parallel group, randomised controlled trial. Lancet Lond Engl 2017;389(10082):1919-29. https://doi.org/10.1016/S0140-6736(17)30188-5
89. Vogelmeier CF, Beeh KM, Schultze M et al. Evaluation of Adherence and Persistence to Triple Therapy in Patients with COPD: A German Claims Data Study. Int J Chron Obstruct Pulmon Dis 2024;19:1835-48. https://doi.org/10.2147/COPD.S460903
90. Mannino D, Bogart M, Wu B et al. Adherence and persistence to once-daily single-inhaler versus multiple-inhaler triple therapy among patients with chronic obstructive pulmonary disease in the USA: A real-world study. Respir Med 2022;197:106807. https://doi.org/10.1016/j.rmed.2022.106807
91. Lin L, Liu C, Cheng W et al. Comparison of treatment persistence, adherence, and risk of exacerbation in patients with COPD treated with single-inhaler versus multiple-inhaler triple therapy: A prospective observational study in China. Front Pharmacol 2023;14:1147985. https://doi.org/10.3389/fphar.2023.1147985
92. Gessner C, Trinkmann F, Bahari Javan S et al. Effectiveness of Extrafine Single Inhaler Triple Therapy in Chronic Obstructive Pulmonary Disease (COPD) in Germany - The TriOptimize Study. Int J Chron Obstruct Pulmon Dis 2022;17:3019-31. https://doi.org/10.2147/COPD.S382405
93. Deslee G, Fabry-Vendrand C, Poccardi N et al. Use and persistence of single and multiple inhaler triple therapy prescribed for patients with COPD in France: a retrospective study on THIN database (OPTI study). BMJ Open Respir Res 2023;10(1):e001585. https://doi.org/10.1136/bmjresp-2022-001585
94. Brusselle G, Himpe U, Fievez P et al. Evolving to a single inhaler extrafine LABA/LAMA/ICS - Inhalation technique and adherence at the heart of COPD patient care (TRIVOLVE). Respir Med 2023;218:107368. https://doi.org/10.1016/j.rmed.2023.107368
95. Alcázar-Navarrete B, Jamart L, Sánchez-Covisa J et al. Clinical Characteristics, Treatment Persistence, and Outcomes Among Patients With COPD Treated With Single- or Multiple-Inhaler Triple Therapy: A Retrospective Analysis in Spain. Chest 2022;162(5):1017-29. https://doi.org/10.1016/j.chest.2022.06.033
96. Bogart M, Bengtson LGS, Johnson MG et al. Outcomes Following Initiation of Triple Therapy with Fluticasone Furoate/Umeclidinium/Vilanterol versus Multiple-Inhaler Triple Therapy Among Medicare Advantage with Part D Beneficiaries and Those Commercially Enrolled for Health Care Insurance in the United States. Int J Chron Obstruct Pulmon Dis 2024;19:97-110. https://doi.org/10.2147/COPD.S424497
97. Celli BR, Fabbri LM, Aaron SD et al. An Updated Definition and Severity Classification of Chronic Obstructive Pulmonary Disease Exacerbations: The Rome Proposal. Am J Respir Crit Care Med 2021;204(11):1251-8. https://doi.org/10.1164/rccm.202108-1819PP
98. Amado Diago CA, Figueira Gonçalves JM, Golpe R et al. Classification of the Severity of COPD Exacerbations in Hospitalized Patients According to Rome vs GesEPOC Criteria. Arch Bronconeumol 2023;59(1):57-8. https://doi.org/10.1016/j.arbres.2022.06.009
99. Jacobson PK, Lind L, Persson HL. Applying the Rome Proposal on Exacerbations of Chronic Obstructive Pulmonary Disease: Does Comorbid Chronic Heart Failure Matter? Int J Chron Obstruct Pulmon Dis 2023;18:2055-64. https://doi.org/10.2147/COPD.S425592
100. Lee HJ, Lee JK, Park TY et al. Validation of the Rome proposal for severity of acute exacerbation of chronic obstructive pulmonary disease. Ther Adv Respir Dis 2023;17:17534666231172917. https://doi.org/10.1177/17534666231172917
101. Reumkens C, Endres A, Simons SO et al. Application of the Rome severity classification of COPD exacerbations in a real-world cohort of hospitalised patients. ERJ Open Res 2023;9(3):00569-2022. https://doi.org/10.1183/23120541.00569-2022
102. Cortes A, Cureño A, Elizondo A, Hernández R, Carranza J. Impacto de las exacerbaciones en la enfermedad pulmonar obstructiva crónica. Exacerbaciones en la EPOC. Respirar 2023;15(2):113-127. https://doi.org/10.55720/respirar.15.2.5
103. Tønnesen P. Smoking cessation and COPD. Eur Respir Rev 2013;22(127):37-43. https://doi.org/10.1183/09059180.00007212
104. Jiménez Ruiz CA, Ramos Pinedo A, Cicero Guerrero A et al. Characteristics of COPD smokers and effectiveness and safety of smoking cessation medications. Nicotine Tob Res 2012;14(9):1035-9. https://doi.org/10.1093/ntr/nts001
105. Jiménez-Ruiz CA, Riesco Miranda JA, Altet Gómez N et al. Treatment of smoking in smokers with chronic obstructive pulmonary disease. Sociedad Española de Neumología y Cirugía Torácica (SEPAR). Arch Bronconeumol 2013;49(8):354-63. https://doi.org/10.1016/j.arbres.2013.02.005
106. Warnier MJ, van Riet EES, Rutten FH et al. Smoking cessation strategies in patients with COPD. Eur Respir J 2013;41(3):727-34. https://doi.org/10.1183/09031936.00014012
107. Chen J, Chen Y, Chen P et al. Effectiveness of individual counseling for smoking cessation in smokers with chronic obstructive pulmonary disease and asymptomatic smokers. Exp Ther Med 2014;7(3):716-20. https://doi.org/10.3892/etm.2013.1463
108. Hilberink SR, Jacobs JE, Bottema BJAM et al. Smoking cessation in patients with COPD in daily general practice (SMOCC): six months’ results. Prev Med 2005;41(5-6):822-7. https://doi.org/10.1016/j.ypmed.2005.08.003
109. Lei S, Li M, Duan W et al. The long-term outcomes of tobacco control strategies based on the cognitive intervention for smoking cessation in COPD patients. Respir Med 2020;172:106155. https://doi.org/10.1016/j.rmed.2020.106155
110. Lou P, Zhu Y, Chen P et al. Supporting smoking cessation in chronic obstructive pulmonary disease with behavioral intervention: a randomized controlled trial. BMC Fam Pract 2013;14:91. https://doi.org/10.1186/1471-2296-14-91
111. Pederson LL, Wanklin JM, Lefcoe NM. The effects of counseling on smoking cessation among patients hospitalized with chronic obstructive pulmonary disease: a randomized clinical trial. Int J Addict 1991;26(1):107-19. https://doi.org/10.3109/10826089109056242
112. Wilson JS, Fitzsimons D, Bradbury I et al. Does additional support by nurses enhance the effect of a brief smoking cessation intervention in people with moderate to severe chronic obstructive pulmonary disease? A randomised controlled trial. Int J Nurs Stud ٢٠٠٨;45(4):508-17. https://doi.org/10.1016/j.ijnurstu.2006.10.001
113. Perez-Padilla R, Fernandez R, Lopez Varela MV et al. Airflow obstruction in never smokers in five Latin American cities: the PLATINO study. Arch Med Res 2012;43(2):159-65. https://doi.org/10.1016/j.arcmed.2012.03.007
114. Pike WJ, Cockayne A, Webster CA et al. Development and design of a novel in vivo chamber implant for the analysis of microbial virulence and assessment of antimicrobial therapy. Microb Pathog 1991;10(6):443-50. https://doi.org/10.1016/0882-4010(91)90109-n
115. Ivey MA, Smith SM, Benke G et al. COPD in Never-Smokers: BOLD Australia Study. Int J Chron Obstruct Pulmon Dis 2024;19:161-74. https://doi.org/10.2147/COPD.S439307
116. Dutta J, Singh S, Greeshma MV et al. Diagnostic Challenges and Pathogenetic Differences in Biomass-Smoke-Induced versus Tobacco-Smoke-Induced COPD: A Comparative Review. Diagn Basel Switz 2024;14(19):2154. https://doi.org/10.3390/diagnostics14192154
117. Fekete M, Horvath A, Santa B et al. Analysis of COPD: Distinguishing Characteristics and Management of Smoking vs Never Smoking Patients. Int J Chron Obstruct Pulmon Dis 2024;19:2671-88. https://doi.org/10.2147/COPD.S484664
118. García Morales OM, Cañas-Arboleda A, Rodríguez Malagón MN et al. Blood eosinophils levels in a Colombian cohort of biomass-and tobacco-related COPD patients. Front Med 2024;11:1321371. https://doi.org/10.3389/fmed.2024.1321371
119. Giraldo-Montoya ÁM, Torres-Duque CA, Giraldo-Cadavid LF et al. Sputum Biomarkers in Wood and Tobacco Smoke Etiotypes of Chronic Obstructive Pulmonary Disease. Int J Chron Obstruct Pulmon Dis 2024;19:1-10. https://doi.org/10.2147/COPD.S439064
120. Gutiérrez-Romero KJ, Falfán-Valencia R, Ramírez-Venegas A et al. Altered levels of IFN-γ, IL-4, and IL-5 depend on the TLR4 rs4986790 genotype in COPD smokers but not those exposed to biomass-burning smoke. Front Immunol 2024;15:1411408. https://doi.org/10.3389/fimmu.2024.1411408
121. Pérez-Padilla R, Ramirez-Venegas A, Sansores-Martinez R. Clinical Characteristics of Patients With Biomass Smoke-Associated COPD and Chronic Bronchitis, 2004-2014. Chronic Obstr Pulm Dis 2014;1(1):23-32. https://doi.org/10.15326/jcopdf.1.1.2013.0004
122. Ramírez-Venegas A, Montiel-Lopez F, Pérez Lara-Albisua JL et al. Association between chronic obstructive pulmonary disease and biomass smoke in rural areas. Int J Tuberc Lung Dis 2022;26(12):1191-3. https://doi.org/10.5588/ijtld.22.0337
123. Torres-Duque CA, García-Rodriguez MC, González-García M. Is Chronic Obstructive Pulmonary Disease Caused by Wood Smoke a Different Phenotype or a Different Entity? Arch Bronconeumol 2016;52(8):425-31. https://doi.org/10.1016/j.arbres.2016.04.004
124. Dharmage SC, Bui DS, Walters EH et al. Lifetime spirometry patterns of obstruction and restriction, and their risk factors and outcomes: a prospective cohort study. Lancet Respir Med 2023;11(3):273-82. https://doi.org/10.1016/S2213-2600(22)00364-2
125. Seo W, Kim HW, Kim JS et al. Long term management of people with post-tuberculosis lung disease. Korean J Intern Med 2024;39(1):7-24. https://doi.org/10.3904/kjim.2023.395
126. Kamenar K, Hossen S, Gupte AN et al. Previous tuberculosis disease as a risk factor for chronic obstructive pulmonary disease: a cross-sectional analysis of multicountry, population-based studies. Thorax 2022;77(11):1088-97. https://doi.org/10.1136/thoraxjnl-2020-216500
127. Fan H, Wu F, Liu J et al. Pulmonary tuberculosis as a risk factor for chronic obstructive pulmonary disease: a systematic review and meta-analysis. Ann Transl Med 2021;9(5):390. https://doi.org/10.21037/atm-20-4576
128. Konstantinidis I, Zou RH, Papageorgiou SN et al. Effect of Human Immunodeficiency Virus on Lung Function and Structure: A Systematic Review and Meta-Analysis. Ann Am Thorac Soc 2025;22(2):274-84. https://doi.org/10.1513/AnnalsATS.202404-384OC
129. Ramírez-Venegas A, Velázquez-Uncal M, Aranda-Chávez A et al. Bronchodilators for hyperinflation in COPD associated with biomass smoke: clinical trial. Int J Chron Obstruct Pulmon Dis 2019;14:1753-62. https://doi.org/10.2147/COPD.S201314
130. González-García M, Torres-Duque CA, Bustos A et al. Bronchial hyperresponsiveness in women with chronic obstructive pulmonary disease related to wood smoke. Int J Chron Obstruct Pulmon Dis 2012;7:367-73. https://doi.org/10.2147/COPD.S30410
131. Ramírez-Venegas A, Montiel-Lopez F, Robles-Hernández RE et al. Effectiveness of ICS/LABA and LAMA/LABA in COPD due to biomass. ERJ Open Res 2024;10(6):00154-2024. https://doi.org/10.1183/23120541.00154-2024
132. Huang TM, Kuo KC, Wang YH et al. Risk of active tuberculosis among COPD patients treated with fixed combinations of long-acting beta2 agonists and inhaled corticosteroids. BMC Infect Dis 2020;20(1):706. https://doi.org/10.1186/s12879-020-05440-6
133. Kim JH, Park JS, Kim KH et al. Inhaled corticosteroid is associated with an increased risk of TB in patients with COPD. Chest 2013;143(4):1018-24. https://doi.org/10.1378/chest.12-1225
134. Lee CM, Heo J, Han SS et al. Inhaled Corticosteroid-Related Tuberculosis in the Real World Among Patients with Asthma and COPD: A 10-Year Nationwide Population-Based Study. J Allergy Clin Immunol Pract 2019;7(4):1197-1206.e3. https://doi.org/10.1016/j.jaip.2018.10.007
135. Shu CC, Wu HD, Yu MC et al. Use of high-dose inhaled corticosteroids is associated with pulmonary tuberculosis in patients with chronic obstructive pulmonary disease. Medicine (Baltimore) 2010;89(1):53-61. https://doi.org/10.1097/MD.0b013e3181cafcd3
136. Sciurba FC, Criner GJ, Christenson SA et al. Mepolizumab to Prevent Exacerbations of COPD with an Eosinophilic Phenotype. N Engl J Med 2025;392(17):1710-20. https://doi.org/10.1056/NEJMoa2413181
137. Bhatt SP, Rabe KF, Hanania NA et al. Dupilumab for COPD with Blood Eosinophil Evidence of Type 2 Inflammation. N Engl J Med 2024;390(24):2274-83. https://doi.org/10.1056/NEJMoa2401304
138. Bhatt SP, Rabe KF, Hanania NA et al. Dupilumab for COPD with Type 2 Inflammation Indicated by Eosinophil Counts. N Engl J Med 2023;389(3):205-14. https://doi.org/10.1056/NEJMoa2303951
139. Anzueto A, Barjaktarevic IZ, Siler TM et al. Ensifentrine, a Novel Phosphodiesterase 3 and 4 Inhibitor for the Treatment of Chronic Obstructive Pulmonary Disease: Randomized, Double-Blind, Placebo-controlled, Multicenter Phase III Trials (the ENHANCE Trials). Am J Respir Crit Care Med 2023;208(4):406-16. https://doi.org/10.1164/rccm.202306-0944OC
140. Sciurba FC, Christenson SA, Rheault T et al. Effect of Dual Phosphodiesterase 3 and 4 Inhibitor Ensifentrine on Exacerbation Rate and Risk in Patients With Moderate to Severe COPD. Chest 2025;167(2):425-35. https://doi.org/10.1016/j.chest.2024.07.168
141. Posthuma R, Van Der Molen MC, Hartman JE et al. Treatable traits in advanced emphysema patients eligible for bronchoscopic lung volume reduction with endobronchial valves. Respir Med 2024;224:107558. https://doi.org/10.1016/j.rmed.2024.107558
142. Buttery SC, Banya W, Bilancia R et al. Lung volume reduction surgery versus endobronchial valves: a randomised controlled trial. Eur Respir J 2023;61(4):2202063. https://doi.org/10.1183/13993003.02063-2022
143. Roodenburg SA, Hartman JE, Deslée G et al. Bronchoscopic Lung Volume Reduction Coil Treatment for Severe Emphysema: A Systematic Review and Meta-Analysis of Individual Participant Data. Respiration 2022;101(7):697-705. https://doi.org/10.1159/000524148
P1: ¿Cuál es la efectividad de la educación individual en inhaloterapia comparada con el cuidado habitual en personas con EPOC?
¿Cuál es la efectividad de la educación individual en inhaloterapia comparada con el cuidado habitual en personas con EPOC? Evidencia de investigación
|
Desenlaces |
Importancia |
Certeza de la evidencia (GRADE) |
|
Exacerbaciones |
CRÍTICO |
⊕⊕⊕◯a Moderada |
|
Hospitalizaciones |
CRÍTICO |
⊕⊕◯◯a,b Baja |
|
Calidad de vida |
CRÍTICO |
⊕⊕◯◯a,d Baja |
|
Técnica correcta del inhalador |
IMPORTANTE |
⊕◯◯◯a,b,d Muy baja |
Tabla S1.2-
¿Cuál es la efectividad de la educación individual en inhaloterapia comparada con el cuidado habitual en personas con EPOC? Resumen de hallazgos
|
Población |
Personas con enfermedad pulmonar obstructiva crónica |
||||
|
Intervención |
Usar educación individual de aerosol terapia |
||||
|
Comparación |
Usar cuidado habitual |
||||
|
Desenlaces |
Efecto relativo (IC 95%) |
Efecto absoluto estimado* |
Certeza de la evidencia (GRADE) |
||
|
CON Educación de aerosol terapia |
CON Cuidado habitual |
Diferencia (IC 95%) |
|||
|
Exacerbaciones Seguimiento 3 meses a 12 meses |
RR 0,44 (0,35 a 0,56) 5 estudios (4–8) 1.330 personas |
107 por cada 1.000 |
244 por cada 1.000 |
137 menos (de 159 menos a 107 menos) |
⊕⊕⊕◯a Moderada |
|
Hospitalizaciones Seguimiento 3 meses a 12 meses |
RR 0,39 (0,30 a 0,51) 4 estudios (4–6,8) 1.172 personas |
108 por cada 1.000 |
276 por cada 1.000 |
168 menos (de 193 menos a 135 menos) |
⊕⊕◯◯a,b Baja |
|
Calidad de vidac Seguimiento 3 meses a 12 meses |
DM 13,25 puntos menosc (21,55 menos a 4,95 menos) 2 estudios(4,8) 296 personas |
⊕⊕◯◯a,d Baja |
|||
|
Técnica correcta inhaladore Seguimiento 3 meses a 12 meses |
RR 1,64 (0,98 a 2,74) 4 estudios(1–3,5) 879 personas |
611 por cada 1.000 |
372 por cada 1.000 |
238 más (de 7 menos a 648 más) |
⊕◯◯◯a,b,d Muy baja |
RR: Riesgo relativo. IC: Intervalo de confianza del 95%. GRADE: grados de evidencia del GRADE Working Group
EXPLICACIONES
*Los riesgos CON educación individual de aerosolterapia están basados en los riesgos del grupo control en los estudios. El riesgo CON cuidado habitual (y su intervalo de confianza) está calculado a partir del efecto relativo (y su intervalo de confianza).
a. Calidad de vida medido en escala SGRQ (St George’s Respiratory Questionnaire). Su puntaje varía de 0 a 100, donde menor puntaje, mejor calidad de vida. La diferencia clínicamente relevante varía entre 7 a 10 puntos según un estudio(11).
b. Se disminuye un nivel de certeza de la evidencia por heterogeneidad I2 > 60%.
c. La técnica correcta del inhalador fue evaluada mediante checklist de acciones independientes desarrolladas por cada autor con un puntaje entre 8 a 18 puntos donde a mayor puntaje, mejor es la técnica del inhalador. Los autores describen que mediante consenso se determinó como evento “uso correcto del inhalador” un puntaje de 90% o más en la checklist.
Figuras: Forest plot
Figura S1.1-
Eventos de exacerbaciones
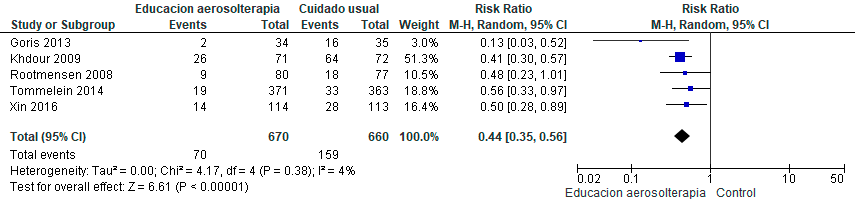
Figura S1.2-
Eventos de hospitalización
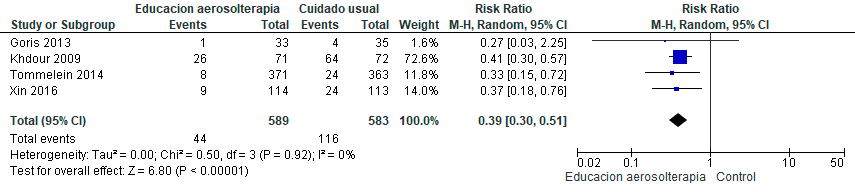
Figura S1.3 -
Calidad de vida
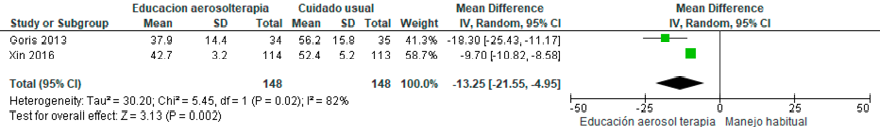
Figura S1.4
Uso correcto técnica del inhalador
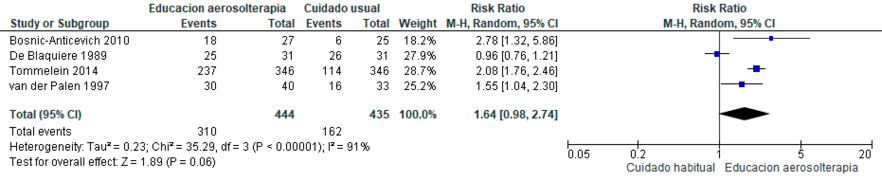
P2:¿Cuál es la efectividad de los programas de incentivo de la actividad física comparado con el cuidado habitual?
Tabla S2.1-
¿Cuál es la efectividad de los programas de incentivo de la actividad física comparado con el cuidado habitual? Evidencia de investigación
|
Desenlaces |
Importancia |
Certeza de la evidencia (GRADE) |
|
Exacerbaciones |
CRÍTICO |
⊕⊕◯◯a,b Baja |
|
Calidad de vida |
CRÍTICO |
⊕◯◯◯a,b,d Muy Baja |
|
Capacidad funcional (6MWD) |
CRÍTICO |
⊕⊕◯◯a,b Baja |
Tabla S2.2-
¿Cuál es la efectividad de los programas de incentivo de la actividad física comparado con el cuidado habitual? Tabla de evidencia.
|
Población |
Personas con enfermedad pulmonar obstructiva crónica |
||||
|
Intervención |
Programa incentivo de la actividad física |
||||
|
Comparación |
Usar cuidado habitual o no participar de actividad física |
||||
|
Desenlaces |
Efecto relativo (IC 95%) |
Efecto absoluto estimado* |
Certeza de la evidencia (GRADE) |
||
|
CON Incentivo actividad física |
CON Cuidado habitual |
Diferencia (IC 95%) |
|||
|
Exacerbaciones Seguimiento 12 meses |
RR 0,87 (0,65 a 1,18) 3 estudios (1,5,6) 639 personas |
192 por cada 1.000 |
221 por cada 1.000 |
29 menos (de 77 menos a 40 más) |
⊕⊕◯◯a,b Baja |
|
Calidad de vidac Seguimiento 8 semanas a 12 meses |
DME 0,45 menos (0,92 menos a 0,40 más) 4 estudios (1–4) 460 personas |
⊕◯◯◯a,b,d Muy Baja |
|||
|
Capacidad funcionale Seguimiento 8 semanas a 12 meses |
DM 3,54 metros más (7,73 menos a 14,82 más) 6 estudios (1–5,7) 946 personas |
⊕⊕◯◯a,b Baja |
|||
RR: Riesgo relativo. DME: diferencia de medias estandarizada. DM: diferencia de medias. IC: Intervalo de confianza del 95%. GRADE: grados de evidencia del GRADE Working Group
EXPLICACIONES
*Los riesgos CON programa de incentivo de la actividad física están basados en los riesgos del grupo control en los estudios. El riesgo CON cuidado habitual (y su intervalo de confianza) está calculado a partir del efecto relativo (y su intervalo de confianza).
a. La calidad de vida fue evaluada mediante los cuestionarios COPD Assessment Test (CAT); St George's Respiratory Questionnaire (SGRQ) y Chronic Respiratory Disease Questionaire (CRDQ). Establecimos que una DME 0.2 representa un efecto pequeño, 0.5 un efecto moderado y cualquier valor superior a 0.8 un efecto grande. Esta regla no tiene en cuenta lo que consideras una diferencia mínimamente importante para un resultado particular.
b. Se disminuye un nivel de certeza de la evidencia por heterogeneidad I2 > 60%.
c. Capacidad funcional de realizar ejercicios con test de marcha en 6 minutos. A mayor cantidad de metros caminados, mayor funcionalidad. Si bien no se encontró la diferencia clínicamente relevante en esta patología, se identificó evidencia en otra población (adultos con diversas patologías) reportando que un cambio relevante sería de 15 a 30 metros(10).
2-Figuras: Forest Plot
Figura S2.1-
Exacerbaciones
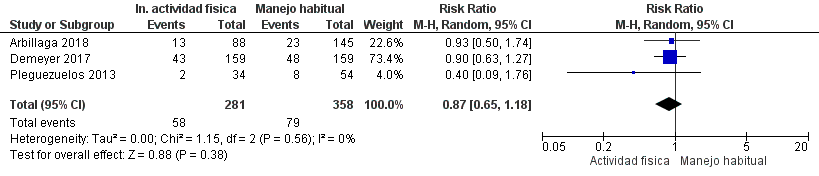
Figura S2.2-
Calidad de vida
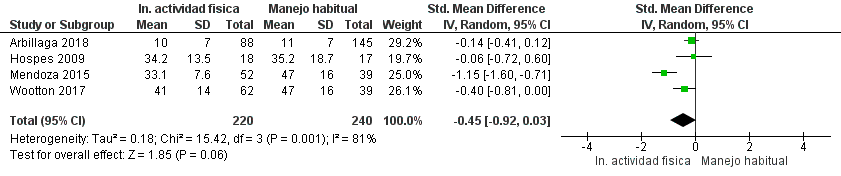
Figura S2.3
Capacidad funcional: Caminata de 6 minutos
El estudio de Pleguezuelos et. al (2013) fue excluido en la síntesis del desenlace capacidad funcional debido a que se identificó sesgo de selección.
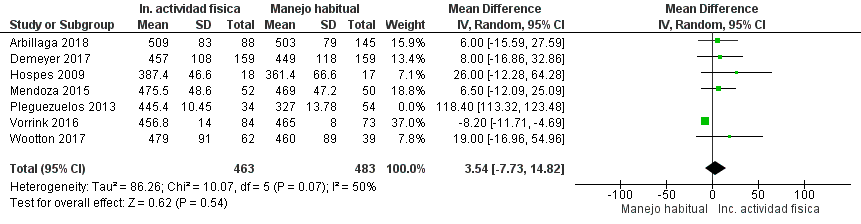
P3: ¿Cuál es el impacto clínico del entrenamiento de músculos inspiratorios (EMI) comparado con el cuidado habitual en los pacientes con EPOC?
Tabla S3.1-
¿Cuál es el impacto clínico del entrenamiento de músculos inspiratorios (EMI) comparado con el cuidado habitual en los pacientes con EPOC? Evidencia de investigación: Entrenamiento de músculos inspiratorios (IMT) + rehabilitación pulmonar (PR) versus rehabilitación pulmonar (PR)
|
Desenlaces |
Importancia |
Certeza de la evidencia (GRADE) |
|
Disnea (mMRC) |
CRÍTICO |
⊕◯◯◯b,c Muy baja |
|
Capacidad funcional (6MWD) |
CRÍTICO |
⊕◯◯◯b,c Muy baja |
|
Calidad de vida (SGRQ) |
CRÍTICO |
⊕⊕◯◯f Baja |
Tabla S3.2-
¿Cuál es el impacto clínico del entrenamiento de músculos inspiratorios (EMI) comparado con el cuidado habitual en los pacientes con EPOC? Evidencia de investigación: Entrenamiento de músculos inspiratorios (IMT) versus control/sham
|
Desenlaces |
Importancia |
Certeza de la evidencia (GRADE) |
|
Disnea (mMRC) |
CRÍTICO |
⊕⊕◯◯b Baja |
|
Capacidad funcional (6MWD) |
CRÍTICO |
⊕⊕⊕◯d Moderada |
|
Calidad de vida (SGRQ) |
CRÍTICO |
⊕⊕◯◯b,f Muy baja |
Tabla S3.3
¿Cuál es el impacto clínico del entrenamiento de músculos inspiratorios (EMI) comparado con el cuidado habitual en los pacientes con EPOC? Tabla de evidencia
|
Población |
Personas con enfermedad pulmonar obstructiva crónica |
||||
|
Intervención |
Usar entrenamiento de músculos inspiratorios (IMT) |
||||
|
Comparación |
Usar control o sham |
||||
|
Desenlaces |
Efecto relativo (IC 95%) |
Efecto absoluto estimado* |
Certeza de la evidencia (GRADE) |
||
|
CON IMT |
CON PR |
Diferencia (IC 95%) |
|||
|
Disnea a Seguimiento 8 meses |
DM 0,59 puntos menos (0,76 menos a 0,43 menos) 4 estudios(18–21) 150 personas |
⊕⊕◯◯b Baja |
|||
|
Capacidad funcional de ejercicioc Seguimiento 2 semanas a 12 meses |
DM 35,71 metros más (25,68 más a 45,74 más) 16 estudios(19–33) 501 personas |
⊕⊕⊕◯d Moderada |
|||
|
Calidad de vidae Seguimiento 3 semanas a 6 meses |
DM 3,85 puntos menos (8,18 menos a 0,48 más) 6 estudios (16,17,19,20,23,34) 182 personas |
⊕⊕◯◯b,f Muy baja |
|||
DM: Diferencia de medias. RR: Riesgo relativo. IC: Intervalo de confianza del 95%. GRADE: grados de evidencia del GRADE Working Group
EXPLICACIONES
*Los riesgos CON entrenamiento de músculos inspiratorios están basados en los riesgos del grupo control en los estudios. El riesgo CON control/sham (y su intervalo de confianza) está calculado a partir del efecto relativo (y su intervalo de confianza).
a. Evaluada mediante mMRC con una escala entre 0 a 4 puntos (peor). Se consideró una diferencia clínicamente relevante un cambio entre -0,5 y -1 punto.
b. Se disminuye un nivel de certeza de la evidencia debido a imprecisión por tamaño óptimo de la información (tamaño muestral inferior a 400 participantes).
c. Evaluado mediante el test de marcha 6 minutos (6MWD). Se consideró una diferencia clínicamente relevante un cambio de 26 metros o más.
d. Se disminuye un nivel de certeza de la evidencia debido a que algunos estudios presentan alto riesgo de sesgo y cierta preocupación.
e. Evaluado mediante cuestionario St. George's Respiratory Questionnaire (SGRQ), Se consideró una diferencia clínicamente relevante un cambio de -4 puntos.
f. Se disminuyen dos niveles por riesgo de sesgo porque la mayoría de las evidencias provienen de estudios con alto riesgo de sesgo y algunas preocupaciones, y los estudios con alto riesgo de sesgo muestran una estimación diferente a los estudios con bajo riesgo de sesgo.
P4: ¿Cuál es el riesgo para desarrollar EPOC en fumadores con espirometría anormal no obstructiva (patrón PRISm) en comparación con fumadores con espirometría normal?
Tabla S4.1-
¿Cuál es el riesgo para desarrollar EPOC en fumadores con espirometría anormal no obstructiva (patrón PRISm) en comparación con fumadores con espirometría normal? Evidencia de investigación
|
Desenlaces |
Importancia |
Certeza de la evidencia (GRADE) |
|
Incidencia de EPOC |
CRÍTICO |
⊕◯◯◯b Muy baja |
Tabla S4.2-
¿Cuál es el riesgo para desarrollar EPOC en fumadores con espirometría anormal no obstructiva (patrón PRISm) en comparación con fumadores con espirometría normal? Tabla de Evidencia
|
Población |
Personas fumadoras sin EPOC |
||||
|
Intervención |
Espirometría anormal no obstructiva (PRISm) |
||||
|
Comparación |
Espirometría normal |
||||
|
Desenlaces |
Efecto relativo (IC 95%) |
Efecto absoluto estimado |
Certeza de la evidencia (GRADE) |
||
|
CON Espirometría PRISm |
CON Espirometría normal |
Diferencia (IC 95%) |
|||
|
Incidencia de EPOCa Seguimiento 3 a 9 años |
No estimable |
En el estudio Park et al. (2018) la incidencia de EPOC en los sujetos con PRISm (17,0/1.000 persona-año [PY]) fue significativamente mayor que en los sujetos normales (4,4/1.000 PY; P < 0,001); sin embargo, la incidencia en individuos con EPOC no revelado (45,1/1.000 PY) fue significativamente mayor que en los individuos con PRISm (P < 0,001)(1). El estudio Wijnant et al. (2019) señaló que dentro de los sujetos del grupo PRISm-P1 (n=135), el 32,6% progresó hacia EPOC (n=44). De las 1.499 personas con espirometría normal, el 19,9% (n=298) progresó a EPOC. El estudio Young COPDGene® et al. (2019) describió que de los 1.375 participantes disponibles para el análisis de progresión en GOLD 0 en la Fase 1, el 4,2% (n=58) convirtió a PRISm, el 6,8% (n=94) convirtió a GOLD 1, y el 2,0% (n=28) convirtió a GOLD 2–4 en la Fase 2 (seguimiento de 5 años). El 36% (n=64) de los 179 participantes disponibles para el análisis de progresión en PRISm en la Fase 1 convirtieron a GOLD 2–4 en la Fase 2. No hubo conversión de PRISm a GOLD 0 o GOLD 1 en la Fase 2. Perez-Padilla et al. (2023) describió que en el grupo PRISm (n=23), el 19,8% progresó hacia EPOC (n=17). Mientras que en el grupo de los sujetos normales (n=1637), el 7,9% progresó hacia EPOC (n=129). |
No estimable |
||
IC: Intervalo de confianza del 95%. GRADE: grados de evidencia del GRADE Working Group
EXPLICACIONES
a. No es posible realizar evaluación de certeza de la evidencia porque el desenlace se presenta de forma narrativa. Se consideró el nivel más bajo de la certeza de la evidencia (muy bajo).
P5: ¿Cuál es el riesgo de hospitalizar y de morir en pacientes con EPOC tabáquico que continúan fumando en comparación con los que dejan de fumar?
Tabla S5.1
¿Cuál es el riesgo de hospitalizar y de morir en pacientes con EPOC tabáquico que continúan fumando en comparación con los que dejan de fumar? Evidencia de investigación
|
Desenlaces |
Importancia |
Certeza de la evidencia (GRADE) |
|
Mortalidad |
CRÍTICO |
No aplica |
|
Hospitalización |
CRÍTICO |
No aplica |
Tabla S5.2
¿Cuál es el riesgo de hospitalizar y de morir en pacientes con EPOC tabáquico que continúan fumando en comparación con los que dejan de fumar? Tabla de evidencia.
|
Población |
Personas con enfermedad obstructiva pulmonar obstructiva crónica |
||||
|
Intervención |
Exposición a tabaco: personas fumadoras |
||||
|
Comparación |
Exfumadores y no fumadores |
||||
|
Desenlaces |
Efecto relativo (IC 95%) |
Efecto absoluto estimado* |
Certeza de la evidencia (GRADE) |
||
|
CON Oxigenoterapia domiciliaria |
CON Cuidado habitual |
Diferencia (IC 95%) |
|||
|
Hersh et al. (2004)2 |
En el modelo multivariable de riesgos proporcionales de Cox, que incluyó a 107 sujetos con datos completos sobre todos los predictores relevantes, las dos variables que miden el consumo de cigarrillos (años-paquete de tabaquismo acumulados y el tabaquismo desde la inscripción en el estudio) se asociaron significativamente con el tiempo de supervivencia, ajustadas por edad, sexo, porcentaje basal de FEV1 respecto al valor predicho y estado de trasplante. Por cada 10 años-paquete de tabaquismo, el riesgo de morir aumentó en un 20% (HR, 1,20; IC del 95%, 1,02 a 1,40), al igual que en el modelo no ajustado. El riesgo de morir en aquellos que fumaron después del ingreso en el estudio siguió siendo elevado comparado con los no fumadores con un HR de 2.50 (IC del 95%, 1,03 a 6,05). |
||||
|
Anthonisen et al. (2005)1 |
La mortalidad fue de 6,04 por cada 1.000 personas-año en los que dejaron de fumar de forma sostenida, 7,77 por cada 1.000 personas-año en los que dejaron de fumar de manera intermitente, y 11,09 por cada 1.000 personas-año en los que continuaron fumando. |
||||
|
Li et al. (2020)4 |
Los fumadores pasivos fueron dados de alta más rápidamente que los fumadores activos, pero de manera similar a los no fumadores (9,8 ± 1,3 vs. 8,2 ± 3,1 vs. 8,6 ± 1,1 días, p < 0,01, para fumadores activos, pasivos y no fumadores, respectivamente). El tiempo de hospitalización ajustado por puntuación basal mMRC, la gravedad de la tos, el índice de oxigenación y la PaCO2 no logró diferencias estadísticamente significativas entre fumadores activos, pasivos y no fumadores (9,5 ± 2,1 vs. 8,4 ± 2,0 vs. 9,2 ± 1,9 días, p = 0,056). |
||||
|
Nielsen et al. (2024)5 |
Los fumadores pasivos fueron dados de alta más rápidamente que los fumadores activos, pero de manera similar a los no fumadores (9,8 ± 1,3 vs. 8,2 ± 3,1 vs. 8,6 ± 1,1 días, p < 0,01, para fumadores activos, pasivos y no fumadores, respectivamente). El tiempo de hospitalización ajustado por puntuación basal mMRC, la gravedad de la tos, el índice de oxigenación y la PaCO2 no logró diferencias estadísticamente significativas entre fumadores activos, pasivos y no fumadores (9,5 ± 2,1 vs. 8,4 ± 2,0 vs. 9,2 ± 1,9 días, p = 0,056). |
||||
|
Kang et al. (2024)3 |
Los fumadores pasivos fueron dados de alta más rápidamente que los fumadores activos, pero de manera similar a los no fumadores (9,8 ± 1,3 vs. 8,2 ± 3,1 vs. 8,6 ± 1,1 días, p < 0,01, para fumadores activos, pasivos y no fumadores, respectivamente). El tiempo de hospitalización ajustado por puntuación basal mMRC, la gravedad de la tos, el índice de oxigenación y la PaCO2 no logró diferencias estadísticamente significativas entre fumadores activos, pasivos y no fumadores (9,5 ± 2,1 vs. 8,4 ± 2,0 vs. 9,2 ± 1,9 días, p = 0,056). |
||||
P6: ¿Cuál es el impacto clínico de la terapia broncodilatadora en pacientes con EPOC que siguen fumando?
Tabla S6.1.
¿Cuál es el impacto clínico de la terapia broncodilatadora en pacientes con EPOC que siguen fumando? Evidencia de investigación
|
Desenlaces |
Importancia |
Certeza de la evidencia (GRADE) |
|
Diferencia absoluta de cambio en FEV1 |
IMPORTANTE |
⊕⊕◯◯a Baja |
|
Calidad de vida (SGRQ) [narrativo] |
CRÍTICO |
No es posible evaluar certeza |
Tabla S6.2
¿Cuál es el impacto clínico de la terapia broncodilatadora en pacientes con EPOC que siguen fumando? Tabla de evidencia.
|
Población |
Personas con enfermedad pulmonar obstructiva crónica intervenidas con terapia broncodilatadora |
||||
|
Exposición |
Personas que continúan fumando |
||||
|
Comparación |
Personas que no continúan fumando |
||||
|
Desenlaces |
Efecto relativo (IC 95%) |
Efecto absoluto estimado* |
Certeza de la evidencia (GRADE) (IC 95%) |
||
|
Continúan fumando |
Exfumadores |
Diferencia |
|||
|
Cambio absoluto FEV1 desde la línea base Seguimiento 3 a 4 años |
DM 20 mL menos (31,76 mL menos a 8,24 menos mL) 2 estudios (2,3) 17.253 personas |
⊕⊕◯◯a Baja |
|||
|
Cambio en la mediana FEV1 Seguimiento 3 años |
En Pauwels et al. (1999) el desenlace se reportó como la mediana de las pendientes del FEV1 (en mililitros por año) durante diferentes partes del estudio. El grupo de budesonida tuvo un efecto más beneficioso en las personas que habían fumado menos. Las personas con un historial de tabaquismo igual o inferior a la mediana de 36 paquetes-año al momento del inicio del estudio tuvieron una mediana de disminución en el FEV1 de 120 ml durante el tratamiento con budesonida. La pérdida de FEV1 en tres años entre los sujetos con más de 36 paquetes-año de tabaquismo fue de 150 ml durante el tratamiento con budesonida. |
||||
|
Calidad de vidae Seguimiento 2 años |
En Tashkin et al. (2010) el desenlace se reportó como la diferencia en los puntajes de calidad de vida entre tiotropio-control utilizando la escala SGRQ en fumadores y no fumadores. En el grupo de personas que continuaron fumando (n=207), la diferencia en el puntaje total de SGRQ entre tiotropio-control fue de -4,63 (-7,26; 2,00) puntos a los 48 meses (seguimiento más largo). Mientras que en las personas que continuaron como exfumadores (n=916), la diferencia en el puntaje total de SGRQ entre tiotropio-control fue de -2,74 (-3,99; -1,48) puntos a los 48 meses. |
||||
DM: Diferencia de medias. RR: Riesgo relativo. IC: Intervalo de confianza del 95%. GRADE: grados de evidencia del GRADE Working Group
EXPLICACIONES
*Los riesgos CON entrenamiento de músculos inspiratorios más rehabilitación están basados en los riesgos del grupo control en los estudios. El riesgo CON rehabilitación pulmonar (y su intervalo de confianza) está calculado a partir del efecto relativo (y su intervalo de confianza).
a. Se disminuye un nivel de certeza de la evidencia por el riesgo de sesgo debido a que todos los estudios fueron clasificados como “some concerns”, dos por omisión de información relevante y uno por ser un análisis post-hoc.
b. Evaluado mediante cuestionario St. George's Respiratory Questionnaire (SGRQ), se consideró una diferencia clínicamente relevante un cambio de -4 puntos.
Figuras: Forest Plot
Figura S6-
Forest plot: Cambio absoluto FEV1 fumadores vs no fumadores
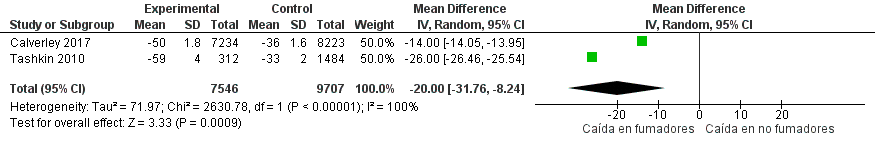
P7: ¿Cuáles son los pacientes con EPOC que al recibir oxigenoterapia domiciliaria presentan reducción de mortalidad?
Tabla S7.1-
¿Cuáles son los pacientes con EPOC que al recibir oxigenoterapia domiciliaria presentan reducción de mortalidad? Evidencia de investigación
|
Desenlaces |
Importancia |
Certeza de la evidencia (GRADE) |
|
Mortalidad |
CRÍTICO |
⊕⊕◯◯a,b Baja |
Tabla S7.2-
¿Cuáles son los pacientes con EPOC que al recibir oxigenoterapia domiciliaria presentan reducción de mortalidad? Tabla de evidencia.
|
Población |
Personas con enfermedad pulmonar obstructiva crónica |
||||
|
Intervención |
Usar oxigenoterapia domiciliaria |
||||
|
Comparación |
Usar cuidado habitual o no oxigenoterapia domiciliaria |
||||
|
Desenlaces |
Efecto relativo (IC 95%) |
Efecto absoluto estimado* |
Certeza de la evidencia (GRADE) |
||
|
CON oxigenoterapia domiciliaria |
CON Cuidado habitual |
Diferencia (IC 95%) |
|||
|
Mortalidad Seguimiento 12 semanas a 24 meses |
RR 1,05 (0,82 a 1,34) 4 estudios (1–3,5) 965 personas |
237 por cada 1.000 |
225 por cada 1.000 |
11 más (de 41 menos a 77 más) |
⊕⊕◯◯a,b Baja |
RR: Riesgo relativo. IC: Intervalo de confianza del 95%. GRADE: grados de evidencia del GRADE Working Group
EXPLICACIONES
*Los riesgos CON oxigenoterapia domicilaria están basados en los riesgos del grupo control en los estudios. El riesgo CON cuidado habitual (y su intervalo de confianza) está calculado a partir del efecto relativo (y su intervalo de confianza).
Figuras
Figura S7-
Forest plot: Mortalidad oxigenoterapia domicilio vs. cuidado habitual
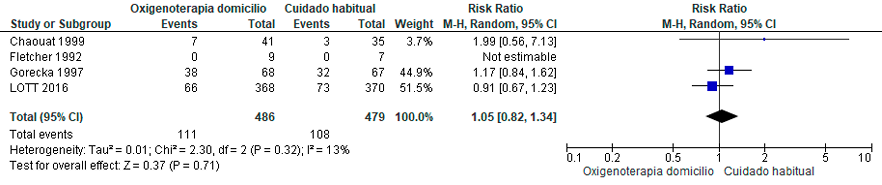
P8: ¿Hay diferencias en el riesgo de hospitalizar y de morir entre la triple terapia en dispositivo único vs. múltiple en pacientes con EPOC?
Tabla S8.1-
¿Hay diferencias en el riesgo de hospitalizar y de morir entre la triple terapia en dispositivo único vs. múltiple en pacientes con EPOC? Evidencia de investigación
|
Desenlaces |
Importancia |
Certeza de la evidencia (GRADE) |
|
Mortalidad |
CRÍTICO |
⊕◯◯◯a,b Muy baja |
|
Exacerbaciones |
CRÍTICO |
⊕⊕◯◯a,c Baja |
|
Eventos adversos serios |
CRÍTICO |
⊕⊕◯◯a,c Baja |
|
Calidad de vida |
CRÍTICO |
⊕⊕◯◯a,c Baja |
|
Adherencia |
Desenlace no evaluado |
|
Tabla S8.2
¿Hay diferencias en el riesgo de hospitalizar y de morir entre la triple terapia en dispositivo único vs. múltiple en pacientes con EPOC? Tabla de evidencia.
|
Población |
Personas con enfermedad pulmonar obstructiva crónica |
||||
|
Intervención |
Triple terapia cerrada (inhalador único) |
||||
|
Comparación |
Triple terapia abierta (multi inhaladores) |
||||
|
Desenlaces |
Efecto relativo (IC 95%) |
Efecto absoluto estimado* |
Certeza de la evidencia (GRADE) |
||
|
CON Triple terapia cerrada |
CON Triple terapia abierta |
Diferencia (IC 95%) |
|||
|
Mortalidad Seguimiento 12a 24 semanas |
RR 0,91 (0,36 a 2,32) 2 estudios(2,3) 3.487 personas |
5 por cada 1.000 |
5 por cada 1.000 |
0 menos (de 3 menos a 7 más) |
⊕◯◯◯a,b Muy baja |
|
Exacerbaciones Seguimiento 12a 24 semanas |
RR 0,92 (0,75 a 1,12) 2 estudios(2,6) 1.442 personas |
199 por cada 1.000 |
216 por cada 1.000 |
17 menos (de 54 menos a 26 más) |
⊕⊕◯◯a,c Baja |
|
Eventos adversos seriosd Seguimiento12a 24 semanas |
RR 1,01 (0,86 a 1,19) 4 estudios (1,3,5,6) 4.596 personas |
218 por cada 1.000 |
216 por cada 1.000 |
2 más (de 30 menos a 41 más) |
⊕⊕◯◯a,c Baja |
|
Calidad de vidae Seguimiento 12 a 24 semanas |
DM 0,1 puntos menos (0,96 menos a 1,16 más) 1 estudio(1) 1.371 personas |
⊕⊕◯◯a,c Baja |
|||
|
Adherencia No reportado |
Desenlace no reportado en los estudios identificados. Revisar tabla de adherencia adjunta |
||||
RR: Riesgo relativo. DM: diferencia de medias. IC: Intervalo de confianza del 95%. GRADE: grados de evidencia del GRADE Working Group
EXPLICACIONES
*Los riesgos CON triple terapia cerrada están basados en los riesgos del grupo control en los estudios. El riesgo CON triple terapia abierta (y su intervalo de confianza) está calculado a partir del efecto relativo (y su intervalo de confianza).
a. Se disminuye un nivel de certeza en la evidencia por imprecisión, dado que los extremos del intervalo de confianza cruzan los umbrales de decisión para considerar la intervención como beneficiosa o perjudicial.
b. Los principales eventos adversos serios fueron exacerbaciones graves de EPOC, neumonía y cardiopatía isquémica (eventos cardiovasculares serios).
c. La calidad de vida fue evaluada mediante el cuestionario St George's Respiratory Questionnaire (SGRQ). La diferencia mínima clínicamente relevante fue establecida en 7.1 puntos de diferencia a 6 meses o más de tratamiento en personas con EPOC severo(9).
Adherencia
Se realizó una búsqueda dirigida no estructurada para el desenlace de adherencia. Se identificaron 9 artículos observacionales recientes.10-18 Favor utilizar esta información con precaución y solo como referencia ya que no comprende la totalidad de la evidencia, fue realizada mediante búsqueda no estructurada, contiene un alto contenido de sesgo de los estudios y es parte de una síntesis narrativa (cualitativa).
Tabla S8.3-
¿Hay diferencias en la adherencia al tratamiento en pacientes que usan triple terapia en dispositivo único vs. múltiple en pacientes con EPOC? Tabla de evidencia.
|
Autor principal |
Diseño |
Población |
Hallazgos |
|
Vogelmeier et al. (2024)10 |
Análisis retrospectivo utilizando la base de datos WIG2 |
Pacientes con EPOC que iniciaron terapia triple (SITT vs. MITT) entre 2017 y 2019 |
Mayor adherencia en SITT (29%) vs MITT (19%) a los 6 meses. Persistencia a 18 meses: 16,5% (SITT) vs 2,3% (MITT) |
|
Manino et al. (2022)11 |
Análisis retrospectivo utilizando la base de datos de reclamaciones IQVIA PharMetrics Plus |
Pacientes con EPOC que iniciaron terapia triple (SITT vs. MITT) entre 2017 y 2019 |
Mayor adherencia para SITT (PDC: 0,66) vs MITT (PDC: 0,48). Persistencia a 12 meses: 35,7% (SITT) vs 13,9% (MITT) |
|
Lin et al. (2023)12 |
Estudio observacional prospectivo multicéntrico en China |
Pacientes con EPOC de diez hospitales entre 2020 y 2021 |
Mayor adherencia (86,5% vs. 79,8%) y persistencia (HR: 1.676) para SITT en comparación con MITT |
|
Halpin et al. (2022)13 |
Estudio de cohorte retrospectivo utilizando datos de atención primaria y secundaria |
Pacientes con EPOC que iniciaron terapia con SITT o MITT entre 2017 y 2019 |
Los usuarios de SITT tuvieron una adherencia significativamente mayor y una persistencia mediana más larga (5,09 meses vs 0,99 meses) |
|
Gessner et al. (2022)14 |
Estudio observacional no intervencionista multicéntrico en Alemania |
2.623 pacientes con EPOC, reclutados entre 2017 y 2020 |
La adherencia mejoró del 67,8% al 76,5% |
|
Deslee et al. (2023)15 |
Estudio de cohorte retrospectivo |
3.134 pacientes con EPOC que iniciaron terapia triple, con 485 en SITT |
La persistencia mediana fue mayor para SITT (181 días) vs MITT (135 días). Persistencia a 1 año: 33% (SITT) vs 18% (MITT) |
|
Brusselle et al. (2023)16 |
Estudio observacional prospectivo |
126 pacientes con EPOC |
La adherencia al tratamiento aumentó del 67,5% en el inicio al 80% después de 6 meses con BDP/FF/G |
|
Bogart et al. (2024)17 |
Estudio retrospectivo utilizando la base de datos Optum Research |
Pacientes con EPOC que iniciaron FF/UMEC/VI o MITT entre 2017 y 2019 |
Mayor adherencia media para FF/UMEC/VI (PDC: 0,51) vs MITT (PDC: 0,37) |
|
Alcázar-Navarrete et al. (2022)18 |
Estudio de cohorte retrospectivo en el mundo real utilizando la base de datos BIG-PAC en España |
Pacientes con EPOC de ≥ 40 años que iniciaron SITT o MITT entre 2018 y 2019 |
Mayor persistencia a los 12 meses para SITT (HR: 1,37; p < 0,001) |
Figuras
Figura S8.1-
Forest plot: Mortalidad Triple terapia abierta vs. triple terapia cerrada
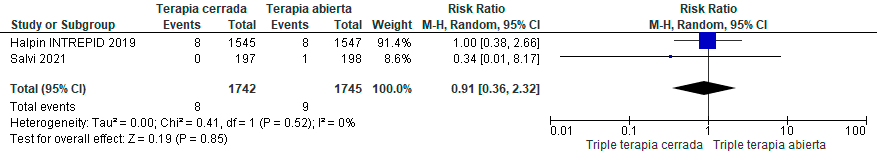
Figura S8.2-
Forest plot: Exacerbaciones triple terapia abierta vs. triple terapia cerrada
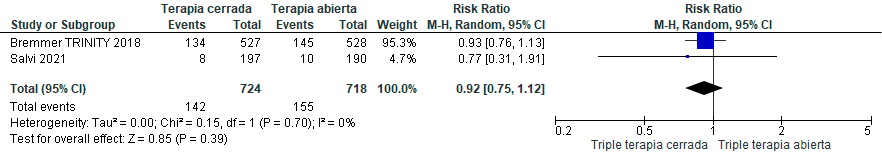
Figura S8.3-
Forest plot: Efectos adversos serios: triple terapia abierta vs. triple terapia cerrada
Se detectó sesgo de publicación en el estudio de Salvi et al.
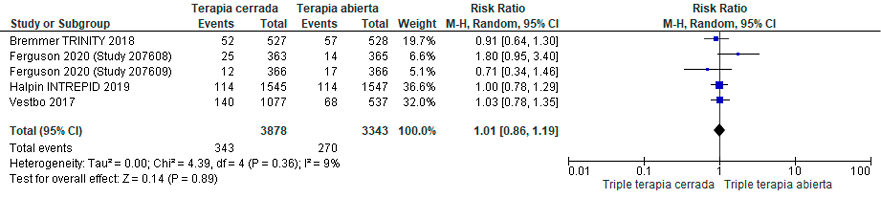
Figura S8.4-
Forest plot: Calidad de vida: triple terapia abierta vs. triple terapia cerrada

P9: ¿Qué clasificación de exacerbaciones de EPOC (E-EPOC) tendría un mayor impacto clínico?
Tabla S9.1-
¿Qué clasificación de exacerbaciones de EPOC (E-EPOC) tendría un mayor impacto clínico? Evidencia de investigación
|
Desenlaces |
Importancia |
Certeza de la evidencia (GRADE) |
|
Mortalidad |
CRÍTICO |
No aplica |
|
Ingreso a UCI |
CRÍTICO |
No aplica |
|
Ventilación mecánica invasiva |
CRÍTICA |
No aplica |
Tabla S9.2-
¿Qué clasificación de exacerbaciones de EPOC (E-EPOC) tendría un mayor impacto clínico? Tabla de Evidencia
|
Población |
Personas con enfermedad obstructiva pulmonar obstructiva crónica |
||||
|
Intervención |
Escala Roma |
||||
|
Comparación |
Escala DECAF o escala GesEPOC 2021 |
||||
|
Desenlaces |
Efecto relativo (IC 95%) |
Efecto absoluto estimado* |
Certeza de la evidencia (GRADE) |
||
|
CON Oxigenoterapia domiciliaria |
CON Cuidado habitual |
Diferencia (IC 95%) |
|||
|
Amado et al. (2023)1 |
Escala Roma comparada con escala GesEPOC: La incidencia de eventos graves (ingreso en la UCI o muerte hospitalaria) es idéntica para las exacerbaciones moderadas según la escala de Roma y las exacerbaciones graves según la escala GesEPOC: 5 casos (23,8%). La incidencia también es idéntica para los casos graves según la escala de Roma y los casos muy graves según la escala GesEPOC: 16 casos (76,2%). Escala Roma comparada con escala DECAF: La puntuación DECAF, que predice el riesgo de muerte en pacientes con EPOC, fue la misma tanto para las exacerbaciones moderadas según la escala de Roma como para las exacerbaciones graves según la escala GesEPOC [1 (rango 1-2)]. La puntuación DECAF también fue la misma para las exacerbaciones graves según la escala de Roma y las exacerbaciones muy graves según la escala GesEPOC [2 (rango 2-3)]. Discrepancias entre escala Roma comparada con GesEPOC: Existe una discrepancia entre las escalas de Roma y GesEPOC, especialmente al clasificar las exacerbaciones leves de EPOC. Posiblemente porque GesEPOC considera la condición basal del paciente para categorizar las exacerbaciones leves, lo cual es crucial para la toma de decisiones clínicas, a diferencia de la escala de Roma. Por otro lado, la escala de Roma requiere que se cumplan tres criterios de gravedad para aumentar la categoría de gravedad, mientras que GesEPOC incrementa la gravedad con solo uno de sus criterios. Esto podría explicar las puntuaciones DECAF más bajas observadas en los pacientes con exacerbaciones leves según la escala GesEPOC, en comparación con aquellos clasificados por la escala de Roma. Las diferencias en los criterios y consideraciones basales entre las dos escalas destacan la importancia de comprender y elegir la escala adecuada para evaluar y gestionar las exacerbaciones de EPOC en la práctica clínica. |
||||
|
Lee et al. (2023)2 |
Comparación clínica de la propuesta Roma estratificada según la gravedad de EPOC: Un mayor número de pacientes en el grupo severo fueron ingresados en la UCI (24,7% frente a 2,1% y 0, p < 0,001) y mostraron una estancia prolongada en la UCI (1,5 días frente a 0,1 y 0 días, p < 0,001) en comparación con aquellos en los grupos moderado y leve. La estancia hospitalaria fue significativamente más prolongada en el grupo severo en comparación con los grupos moderado y leve (8 días frente a 7 y 5 días, p < 0,001). La estadía hospitalaria fue significativamente más prolongada en el grupo severo en comparación con los grupos moderado y leve (8 días frente a 7 y 5 días, p < 0,001). La necesidad de oxígeno, incluyendo la terapia de oxígeno convencional o el oxígeno nasal de alto flujo, aumentó significativamente con la gravedad de la exacerbación agua EPOC. Un mayor número de pacientes recibieron ventilación no invasiva (19,5% frente a 1,84% y 0%, p < 0,001) o ventilación mecánica invasiva (18,2% frente a 0,5% y 0%, p < 0,001) en el grupo severo en comparación con los grupos moderado y leve. El grupo severo tuvo una mayor mortalidad hospitalaria (6,5% frente a 1,2% y 0%, p < 0,001) que los grupos moderado y leve.La sensibilidad y especificidad de la propuesta Roma fue de 0,679 y 0,919 para la admisión en la UCI; 0,727 y 0,925 para la ventilación no invasiva o ventilación mecánica invasiva; y 0,901 y 0,779 para la mortalidad hospitalaria respectivamente. Escala Roma comparada con escala GesEPOC 2021: La propuesta de Roma tuvo un rendimiento predictivo significativamente mejor para la admisión en la UCI (AU-ROC=0,850 frente a 0,736, p=0,004) y la necesidad de ventilación no invasiva o ventilación mecánica invasiva (AU-ROC=0,870 frente a 0,770, p=0,004) en comparación con los criterios de GesEPOC 2021. Escala Roma comparada con escala DECAF: Aunque las AU-ROC para la admisión en la UCI, ventilación no invasiva o ventilación mecánica invasiva, y mortalidad hospitalaria fueron más altas en la propuesta de Roma en comparación con la puntuación DECAF, estas diferencias no fueron estadísticamente significativas |
||||
|
Reumkens et al. (2023)3 |
La clasificación tradicional de la gravedad categorizó la severidad de la EPOC de los 364 pacientes como grave, ya que todos fueron hospitalizados debido al evento. En cambio, al implementar los criterios de la propuesta de Roma, 52 (14,3%) pacientes tenían una EPOC leve, 204 (56,0%) pacientes una EPOC moderada y 108 (29,7%) pacientes una EPOC grave. Además, de los 31 pacientes que murieron en el hospital, 14 (3,8%) pacientes tenían una EPOC moderada, mientras que 15 (4,1%) pacientes fueron clasificados como graves. Así, la mortalidad hospitalaria en eventos leves, moderados y graves fue del 3,8%, 6,9% y 13,9%, respectivamente. La proporción de pacientes que murieron a los 30 y 90 días fue mayor en el grupo de EPOC grave, pero también se observaron muertes en los eventos leves y moderados (30 días: leve 7,7%, moderado 7,4%, grave 17,6%; 90 días: leve 7,7%, moderado 13,7%, grave 25,0%) |
||||
|
Zeng et al. (2024)4 |
La incidencia de ingreso en la UCI (6,4% vs 12,0% vs 14,9%, P <0,001), ventilación mecánica (11,7% vs 33,7% vs 45,3%, P <0,001) y ventilación mecánica invasiva (1,4% vs 6,8% vs 8,9%, P <0,001) aumentó con la gravedad de la exacerbación aguda de EPOC entre el grupo leve hasta el grupo grave según la clasificación de gravedad de Roma. Aunque los grupos moderado y grave tuvieron una mayor mortalidad a los 60 días que el grupo leve (3,5% vs 1,9%, 4,3% vs 1,9%, P <0,05, respectivamente), la mortalidad en el grupo grave fue muy cercana a la del grupo moderado (3,5% vs 4,3%, P >0,05). Los resultados de la mortalidad hospitalaria describieron la misma tendencia; la diferencia de mortalidad hospitalaria entre los grupos moderado y grave no fue significativa (2,5% vs 2,6%, P >0,05) a pesar de que los grupos moderado y grave tuvieron una mayor mortalidad que el grupo leve, respectivamente (2,6% vs 1,1%, 2,5% vs 1,1%, P <0,05). Del mismo modo, el riesgo de fallecer a los 60 días después del ingreso fue significativamente mayor en los grupos moderado y grave que en el grupo leve (OR: 2,38 vs 1, 1,92 vs 1,00, respectivamente, P=0,001), mientras que no hubo una diferencia significativa en el riesgo de mortalidad a los 60 días entre el grupo grave y el grupo moderado (OR: 0,81 vs 1,00, P=0,206). El incremento en la clasificación de gravedad de Roma se asoció significativamente con un mayor riesgo de ingreso en la UCI (leve vs moderado vs grave OR: 1,00 vs 1,97 vs 2,55, P <0,001) y ventilación mecánica invasiva (leve vs moderada vs grave OR: 1,00 vs 5,15 vs 6,91, P <0,001). La clasificación de gravedad de Roma podría distinguir excelentemente el riesgo de ingreso en la UCI, ventilación no invasiva y ventilación mecánica invasiva. Sin embargo, se necesitan más estudios para determinar si puede discriminar de manera confiable el riesgo de mortalidad a corto plazo. |
||||
P10: ¿Cuáles medidas no farmacológicas son útiles para lograr la cesación tabáquica en pacientes con EPOC?
Tabla S10.1:
¿Cuáles medidas no farmacológicas son útiles para lograr la cesación tabáquica en pacientes con EPOC? Evidencia de investigación
|
Desenlaces |
Importancia |
Certeza de la evidencia (GRADE) |
|
Mortalidad |
CRÍTICO |
⊕◯◯◯a,b Muy baja |
|
Tasa de abstinencia |
CRÍTICO |
⊕⊕⊕◯a Moderada |
Tabla S10.2:
¿Cuáles medidas no farmacológicas son útiles para lograr la cesación tabáquica en pacientes con EPOC? Tabla de evidencia
|
Población |
Personas fumadoras con enfermedad pulmonar obstructiva crónica |
||||
|
Intervención |
Usar programa de cesación tabáquica individual no farmacológica |
||||
|
Comparación |
Usar consejería breve o cuidado habitual |
||||
|
Desenlaces |
Efecto relativo (IC 95%) |
Efecto absoluto estimado* |
Certeza de la evidencia (GRADE) |
||
|
CON Cesación tabáquica |
CON Cuidado habitual |
Diferencia (IC 95%) |
|||
|
Mortalidad Seguimiento 10 años |
RR 0,60 (0,32 a 1,13) 1 estudio (1) 94 personas |
238 por cada 1.000 |
396 por cada 1.000 |
158 menos (de 269 menos a 51 más) |
⊕◯◯◯a,b Muy baja |
|
Tasa de abstinenciac Seguimiento 6 meses a 48 meses |
RR 1,83 (1,35 a 2,49) 5 estudios (1,2,4–6) 696 personas |
261 por cada 1.000 |
142 por cada 1.000 |
118 más (de 50 más a 212 más) |
⊕⊕⊕◯a Moderada |
RR: Riesgo relativo. IC: Intervalo de confianza del 95%. GRADE: grados de evidencia del GRADE Working Group
EXPLICACIONES
*Los riesgos CON educación individual programa de cesación tabáquica no farmacológica individual están basados en los riesgos del grupo control en los estudios. El riesgo CON cuidado habitual (y su intervalo de confianza) está calculado a partir del efecto relativo (y su intervalo de confianza).
a. Se disminuye un nivel de certeza de la evidencia por riesgo de sesgo.
b. Se disminuyen dos niveles de certeza en la evidencia por imprecisión, dado que los extremos del intervalo de confianza cruzan los umbrales de decisión para considerar la intervención como beneficiosa o perjudicial y por el bajo número de eventos (tamaño óptimo de la información).
c. La tasa de abstinencia fue determinada mediante auto reporte utilizando un cuestionario elaborado por los propios autores; o mediante el Fagerstrom Test for Nicotine Dependence (FTND) y/o mediciones de CO2 que determinaban la prevalencia puntual de abstinencia en los últimos 7 días o desde la semana cuatro hasta sexto mes.
Figuras
Figura S10.1-
Forest plot: Mortalidad Programa de cesación tabáquica vs. manejo habitual
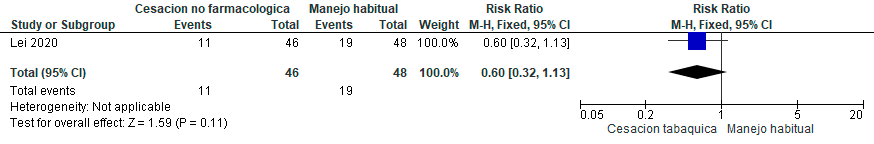
Figura S10.2-
Forest plot: Tasa de abstinencia: Programa de cesación tabáquica vs. manejo habitual