

ARTÍCULO ORIGINAL | Respirar, 2025; 17(3): 307–317 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.17.3.8
María Victoria Iraola
https://orcid.org/0000-0002-3807-449X
Nicolás Tommasino
https://orcid.org/0000-0002-7437-8933
Laura Bodega
https://orcid.org/0000-0002-8743-4746
Agustina Banchero
https://orcid.org/0000-0002-4515-2847
Eduardo Quintana
https://orcid.org/0000-0002-2509-3042
Nicolás Arechavaleta
https://orcid.org/0000-0002-4526-024X
Ana Inés Gruss
https://orcid.org/0000-0002-9616-7985
Recibido:
26 enero 2025
Aprobado:
16 mayo 2025
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
EBUS-L en un centro de endoscopia respiratoria intervencionista en Latinoamérica: rendimiento diagnóstico, correlación con SUV del PET y tamaño ganglionar. Estudio de vida real
EBUS-L in a Latin American Interventional Respiratory Endoscopy Center: Diagnostic Performance, Correlation with PET SUV and Lymph Node Size. A Real-Life Study
María Victoria Iraola , Nicolás Tommasino
, Nicolás Tommasino , Laura Bodega
, Laura Bodega , Agustina Banchero*
, Agustina Banchero* , Eduardo Quintana
, Eduardo Quintana , Nicolás Arechavaleta
, Nicolás Arechavaleta , Ana Inés Gruss
, Ana Inés Gruss
Universidad de la República, Facultad de Medicina, Instituto del Tórax,
Unidad académica de Neumología, Montevideo, Uruguay
* Centro Uruguayo de Imagenología Molecular (Cudim), Montevideo, Uruguay
Autor CORRESPONSAL:
María Victoria Iraola, mariavictoria.iraola@gmail.com
Resumen
Introducción: Este estudio presenta la experiencia con la ecobroncoscopía en modalidad lineal (EBUS-L) en la Unidad de Endoscopia Respiratoria Intervencionista del Hospital Maciel, durante el período de noviembre de 2019 a febrero de 2023.
Metodología: Se analizaron un total de 122 procedimientos de EBUS-L. El objetivo principal del EBUS fue la estadificación y el diagnóstico del cáncer broncopulmonar, que representó el 49,1% de los casos analizados.
Resultados: Se destacó una alta tasa de muestras aptas (98,4%). Se encontró una correlación estadísticamente significativa entre el tamaño de las adenopatías (≥ 15 mm) y el SUV en el PET-TC (≥ 3,75) con la etiología maligna.
Conclusiones: Los resultados sugieren que el EBUS-L es eficaz en la estadificación y diagnóstico de cáncer broncopulmonar, especialmente en adenopatías de mayor tamaño y SUV elevado.
Palabras clave: EBUS, PET-TC, patología mediastinal.
Abstract
Introduction: This study presents the experience with linear endobronchial ultrasound (EBUS-L) in the Interventional Respiratory Endoscopy Unit of Hospital Maciel from November 2019 to February 2023.
Methods: A total of 122 procedures were analyzed, with the primary objective of EBUS being the staging and diagnosis of bronchopulmonary cancer, which accounted for 49.1% of the cases.
Results: The analysis focused on the correlation between malignant etiology and two main variables: the size of the lymphadenopathy and its standardized uptake value (SUV). Notably, a high rate of adequate samples (98.4%) was achieved and a statistically significant relationship was found between lymphadenopathy ≥ 15 mm, an SUV in PET-CT ≥ 3.75, and malignant etiology.
Conclusion: The findings indicate that EBUS-L is an effective tool for the staging and diagnosis of bronchopulmonary cancer, particularly in cases with larger lymphadenopathy and elevated SUV values.
Keywords: interventional pneumology, EBUS-L , real-life study.
La ecobroncoscopía en modalidad lineal (EBUS-L) es una técnica que combina la broncoscopia convencional con la ecografía, lo que permite al operador una doble visión, endoscópica y ecográfica, en tiempo real al momento de tomar muestras. Las mismas son obtenidas mediante punción por aspiración con aguja fina (PAAF).1 Es una herramienta para el diagnóstico de patología mediastinal tanto maligna como benigna, que en las últimas dos décadas, ha emergido como una técnica muy efectiva para la toma de muestras peribronquiales, mediastinales y masas pulmonares, jugando un rol principal en el diagnóstico y estadificación del cáncer de pulmón no pequeñas células (CPNCP).1-3 A nivel nacional, el primer y único centro en contar con esta tecnología es la Unidad de Endoscopia Respiratoria Intervencionista del Instituto del Tórax en el Hospital Maciel, ASSE, en Montevideo. Este trabajo refleja la experiencia adquirida por el servicio, comparándola con las cifras globales, y en correlación con técnicas de estadificación mediastinal no invasivas disponibles en el país como la tomografía por emisión de positrones (PET-TC), la cual combina las imágenes por tomografía con la administración de un radiotrazador que es captado por células metabólicamente activas, y brinda información sobre la actividad y metabolismo de las estructuras encontradas. Además, busca conocer si existe una relación entre el tamaño de los ganglios puncionados, su captación a nivel del PET-TC y la etiología maligna.
1. Evaluar la rentabilidad diagnóstica del EBUS-L como herramienta diagnóstica en el contexto de patologías mediastinales durante su período inicial de adopción (2019-2023) en el Servicio de Endoscopia Respiratoria del Hospital Maciel, Montevideo, Uruguay.
2. Analizar y comparar los resultados del EBUS-L en nuestro centro con los datos y conclusiones reportados en la literatura médica a nivel global, con el fin de contextualizar y validar su rendimiento diagnóstico.
3. Investigar la correlación entre el valor del SUV (Standardized Uptake Value) obtenido en estudios PET-TC locales y la etiología de las adenopatías mediastinales.
4. Determinar si existe una asociación significativa entre el tamaño de los ganglios mediastinales medidos mediante EBUS-L y la naturaleza de los mismos.
5. Analizar la implementación de la estadificación mediastinal trimodal: TC, PET-TC y EBUS-L en el diagnóstico del cáncer de pulmón.
Estudio descriptivo, retrospectivo, de pacientes que se realizaron EBUS-L en el período noviembre 2019 y febrero 2023 en la Unidad de Endoscopia Respiratoria Intervencionista del Hospital Maciel. Datos obtenidos de revisión de historias clínicas y base de datos de la unidad. Los valores del PET–TC fueron provistos por el Centro Uruguayo de Imagenología Molecular (CUDIM), centro especializado para el diagnóstico y la investigación de enfermedades oncológicas en Uruguay.
El procedimiento se efectúa bajo anestesia general con ventilación mediante máscara laríngea i-gel, con monitorización electrocardiográfica, con saturometría y capnografía. Se utilizó Equipo Fujifilm® EB-530US acoplado a un procesador de imagen de la misma marca, utilizando agujas Vizishot 21 o 22G de Olympus®. El sistema combina un broncoscopio flexible con transductor ultrasónico lineal (7.5-12 MHz) que proporciona imágenes de alta resolución, lo que permite la visualización en tiempo real de las estructuras mediastínicas y la punción precisa bajo guía ecográfica. Se realizan sistemáticamente 4 pases por cada ganglio puncionable para optimizar la obtención de material. Se define como ganglio puncionable a todo ganglio mayor o igual a 5 mm de diámetro menor medido en la imágen ultrasonográfica.2
Como fortaleza destacada de nuestra Unidad, contamos con “rapid on site examination” ROSE, es decir, las muestras de punción con aguja fina (PAAF) obtenidas mediante el EBUS son analizadas por médicos anatomopatólogos presentes en la sala de intervenciones, lo que reduce el número de punciones en los ganglios en los que que se constata que no hay afectación.
Esta investigación se ajusta a la Declaración Universal sobre Bioética y Derechos Humanos y la Declaración de Helsinki,15 cuenta asimismo con la aprobación del comité de ética correspondiente. Todos los pacientes firmaron consentimiento informado para la realización del procedimiento y uso de sus datos personales, los cuales fueron anonimizados para su análisis.
Análisis estadístico
Para el análisis estadístico se utilizó el software IBM SPSS Statistics- v.20. Las variables categóricas se presentan mediante sus frecuencias absolutas y relativas. Las variables cuantitativas se presentan mediante las medidas de tendencia central (media ± 1 desviación estándar). Las variables cualitativas se expresan en frecuencia absoluta y sus respectivos porcentajes. Se utilizó el test de t de Student para comparar las variables continuas y el test del chi cuadrado (o Fisher) para las variables cualitativas. Cuando correspondía, se utilizó el test de ANOVA. Para las pruebas de contraste de hipótesis, los valores de p < 0,05 se consideraron significativos.
Criterios de inclusión:
Todos los pacientes que se realizaron EBUS lineal con fines diagnósticos, de estadificación o re-estadificación entre noviembre 2019 y marzo 2023.
Criterios de exclusión:
Informe del procedimiento con datos insuficientes para este análisis.
Anatomía patológica no realizada en el Hospital Maciel.
Resultados
De los 126 EBUS realizados (2019-2023), 122 cumplieron criterios de inclusión (exclusión 4 en total: 2 sin estudio AP, 2 muestras insuficientes). Se puncionaron 194 ganglios, tamaño medio: 12,8±6,2 mm. La cohorte (n=122) mostró predominio masculino (69%) con edad media de 62,6 ± 10,2 años.
Figura 1.
Flujograma de procedimientos incluidos en el trabajo.
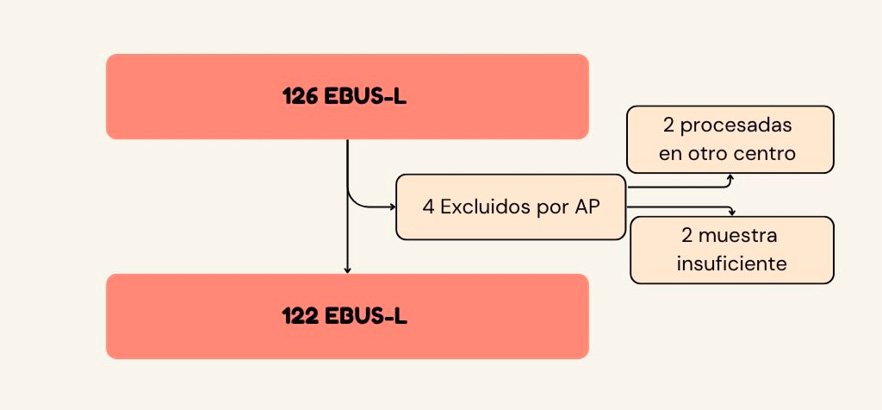
En la tabla 1 se exponen las causas de solicitud del procedimiento que denominamos “objetivo del EBUS”, la frecuencia de punción de los diferentes grupos ganglionares y el tamaño de las adenopatías puncionadas.
Tabla 1.
Objetivo de los procedimientos realizados, características de grupos ganglionares puncionados.
|
EBUS analizados |
n=122 |
|
Objetivo del EBUS |
|
|
Estadificación n (%) |
4 (3,2%) |
|
Diagnóstico y de estadificación n (%) |
60 (49,1%) |
|
Diagnóstico n (%) |
57 (46,7%) |
|
Reestadificador |
1 (0,8%) |
|
Adenopatías (cadenas ganglionares) puncionados n (%) |
n= 194 |
|
GRUPO ganglionar puncionado |
|
|
2R |
4 (2,1%) |
|
2L |
2 (1,0%) |
|
4R |
55 (28,4%) |
|
4L |
29 (14,9%) |
|
7 |
52 (26,8%) |
|
10R |
10 (7,2%) |
|
10L |
5 (2,6%) |
|
11RS |
19 (9,8%) |
|
11RI |
4 (2,1%) |
|
11L |
14 (7,2%) |
|
Tamaño de adenopatías puncionadas (mm) X±DE |
12,8 ± 6,2 |
|
Nro. de pases por adenopatia (media ± DE) |
3,9 ± 1,8 |
Figura 2.
Algoritmo de etiologias de EBUS-L y EBUS-L + mediastinoscopia.
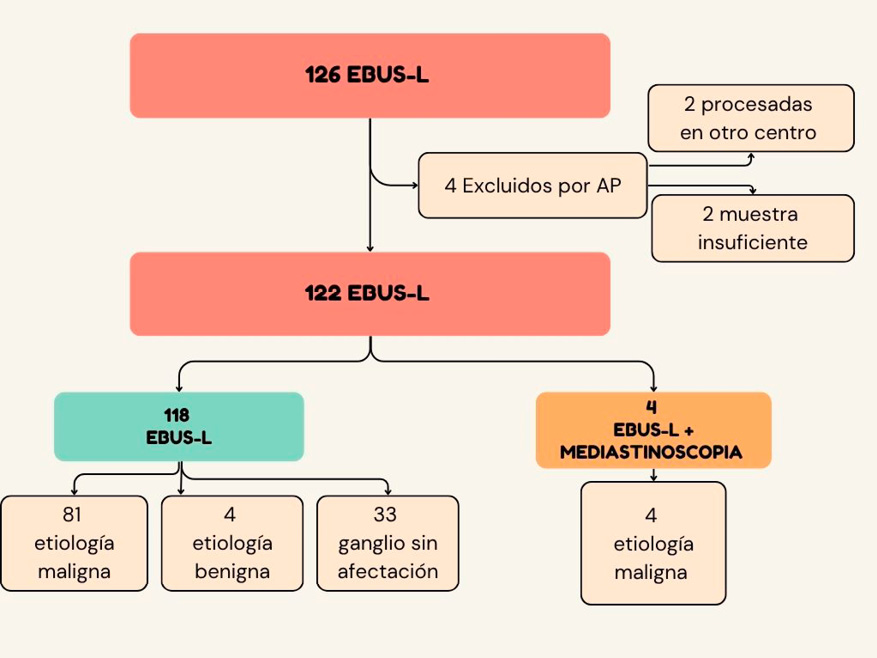
Se realizaron un total de 4 (3,2%) mediastinoscopias, de las cuales dos fueron concordantes con el resultado del EBUS-L (1,6%) y dos fueron discordantes (1,6%) y correspondieron a pacientes con linfoma.
En la tabla 2 se detalla el análisis anatomo–patológico de cada una de las muestras y en la tabla 3 se exponen los datos recabados sobre el PET-TC.
Tabla 2.
Resultados de anatomía patológica de los ganglios muestreados.
|
Muestras aptas n (%) |
194 (98,4%) |
|
ROSE realizado/cadenas ganglionares puncionadas |
N = 137/194 (70,6%) |
|
Concordante con definitivo |
127 (93,4%) |
|
Discordante con definitivo |
9 (6,6%) |
|
Tipo de patologia n (%) |
|
|
Benigna |
4 (3,5%) |
|
Maligna |
85 (68,5%) |
|
Ganglio no afectado |
33 (26,6%) |
|
Patologia maligna |
N 85/122 (68,5%) |
|
Cáncer pulmón |
73/85 (85,9%) |
|
No peq células |
61 (83,5%) |
|
Adenocarcinoma |
34 (50,8%) |
|
Escamoso |
13 (18%) |
|
Pobremente diferenciado |
13 (18%) |
|
Peq células |
6/85 (8,2%) |
|
Neuroendocrino |
6 (8,2%) |
|
Otros |
8/85 (9,4%) |
|
Mama |
2 (1,6%) |
|
Urotelial |
2 (1,6%) |
|
Digestivo |
1 (0,8%) |
|
Renal |
2 (1,6%) |
|
Cuello uterino |
1 (0,9%) |
|
Patologia benigna |
n 4/122 (3,5%) |
|
Sarcoidosis |
3 (2,4%) |
|
Tuberculosis |
1 (0,8%) |
Tabla 3.
Características de PET-TC
|
PET-TC realizado n (%) |
64 (51,6%) |
|
SUV media ± DE |
6,1 ± 5,1 |
|
Valor de SUV de cadena ganglionar de etiologia maligna ± DE |
8,7 ± 4,6 |
En la tabla 4 se expone la frecuencia de solicitud de EBUS y PET-TC a través de los años.
Tabla 4.
Evolución cronológica de la frecuencia de solicitud de PET en función de la cantidad de procedimientos realizados.
|
Año de realización del procedimiento |
Total de EBUS realizados |
PET-TC pre-procedimiento |
Sin PET-TC pre-procedimiento |
|
|
2019 (2 meses) |
n=4 |
1 |
3 |
|
|
2020 |
n=48 |
27 |
22 |
|
|
2021 |
n=30 |
13 |
17 |
|
|
2022 |
n=35 |
17 |
18 |
|
|
2023 (2 meses) |
n=7 |
6 |
1 |
p 0,092 |
Tabla 5.A.
Relación tamaño-etiología (patológico/no patológico).
|
Tamaño ecográfico n= 160/194 |
Patológico |
No patológico |
p 0,000046 |
|
< 15 mm (107) |
62 |
45 |
|
|
> 15 mm (53) |
46 |
7 |
Tabla 5.B.
Relación tamaño-etiología (benigno/maligno/sin afectación).
|
Tamaño ecográfico n=160/194 |
Benigno |
Maligno |
Sin afectación |
p 0,0011 |
|
< 15 (107) |
2 |
60 |
45 |
|
|
> 15 (53) |
1 |
45 |
7 |
Figura 3.
Rentabilidad del EBUS-L según se relacionan las variables tamaño y etiología maligna graficado mediante curva ROC.

El tamaño de corte de 15 mm se determinó mediante un análisis de la relación entre malignidad y tamaño (Tabla 5.A). Seleccionamos este punto de corte por ser un valor equilibrado, que combina una sensibilidad aceptable (60%) con una especificidad elevada (80%).
La literatura internacional reporta hallazgos contradictorios respecto al valor predictivo del tamaño ganglionar para malignidad.2 Esta variabilidad podría atribuirse a diferencias en los criterios diagnósticos de adenomegalia entre estudios. Si bien el consenso actual define adenomegalia como un diámetro ecográfico ≥10 mm,2 nuestros resultados coinciden con aquellos trabajos que demuestran una correlación estadísticamente significativa entre el incremento del tamaño nodal y la probabilidad de malignidad (p=0,000046), particularmente en ganglios ≥15 mm.
Por otra parte, en la tabla 6 se realizó un análisis similar para conocer la relación entre el valor del SUV y la etiología del ganglio.
Tabla 6.
Relación SUV-etiología.
|
SUV n=110/194 |
Etiologia Maligna |
Ganglio sin afectación |
p 0,00001 |
|
< 3,75 |
20 |
27 |
|
|
> 3,75 |
54 |
9 |
Figura 4.
Rentabilidad del EBUS según se relacionan las variables valor del SUV y etiología maligna graficado mediante curva ROC.

El análisis mediante curvas ROC identificó un valor de SUV ≥3,75 como el punto de corte óptimo para evaluar el rendimiento diagnóstico de la EBUS en la diferenciación entre adenopatías malignas y benignas. Este umbral demostró una asociación estadísticamente significativa con la presencia de malignidad (p<0,0001), lo que confirmó la utilidad del parámetro metabólico como marcador diagnóstico.
Por otra parte, en los casos que el SUV del PET-TC fue mayor o igual a 3,75; la sensibilidad fue del 90% y la E de 40% para el diagnóstico de etiología maligna. En el caso del SUV promedio de los ganglios puncionados, que fue de 6,1; la sensibilidad fue mayor al 70% y la especificidad mayor al 80%.
En general, la sensibilidad y la especificidad de la PET-TC para identificar metástasis mediastínicas son aproximadamente del 62% y 90%, respectivamente, sin embargo, es menos sensible para ganglios con diámetros entre 7 y 10 mm.4-6.
Los resultados falsos positivos (20-25%) se pueden producir en procesos en los que hay un incremento de la glicólisis (procesos inflamatorios, granulomatosis, antracosis, ganglios linfáticos reactivos y ganglios linfáticos que se han puncionado recientemente). Los falsos negativos de la PET- TC se producen cuando hay un deterioro del flujo sanguíneo que puede llevar a necrosis o en procesos con una baja actividad metabólica (carcinoides, adenocarcinomas).3-6.
Se destaca en nuestro centro la utilización del EBUS-L como herramienta para el diagnóstico de diversas patologías, tanto malignas como benignas. Destaca dentro de las indicaciones por frecuencia, el diagnóstico y estadificación del CPNCP en el mismo acto, tal como se recomienda en las Guías de Práctica Clínica y en línea con la disminución en el tiempo entre el diagnóstico y el tratamiento oncológico, y su impacto en la sobrevida de los pacientes.3
El sistema de estadificación TNM para el cáncer de pulmón permite caracterizar la extensión de la enfermedad combinando 3 componentes: tamaño del tumor principal (T), afectación linfática (N) y extensión metastásica (M). La combinación de estos componentes define distintos estadios de enfermedad, que se correlacionan con las posibilidades de tratamiento y pronóstico del paciente.11
En la 9na edición (2024) de la IASLC, la afectación linfática sufrió modificaciones al subdividir la estación N2 en a y b dependiendo de si hay compromiso ipsilateral y/o mediastinal.11
En la tabla 7 se muestran los estadios de estadificación nodal.
Tabla 7.
Estadios de estadificación nodal
|
Nx |
Desconocido |
|
N0 |
Sin afectación nodal metastásica |
|
N1 |
Compromiso nodal peribronquial y/o hiliar ipsilateral. |
|
N2 |
N2a - Compromiso nodal ipsilateral mediastinal o subcarinal |
|
N3 |
Compromiso nodal contralateral (mediastinal, hiliar, escaleno) o supraclavicular. |
La sensibilidad y especificidad teóricas del EBUS-L para el diagnóstico de adenopatías malignas en pacientes con CPNCP son 92,3% y 100%, respectivamente, con un valor predictivo positivo de 100% y un valor predictivo negativo de 97,4%.1
La gran mayoría (98,4%) de las muestras obtenidas fueron aptas para análisis y conclusiones desde el punto de vista anatomopatológico (ROSE y definitivo), lo que refleja la calidad en términos diagnósticos.
La discordancia entre el Rapid On-Site Evaluation (ROSE) y el diagnóstico anatomopatológico final en muestras de EBUS puede explicarse por las limitaciones inherentes a ambas técnicas. El ROSE, al evaluar extensiones citológicas no fijadas, es susceptible a artefactos por aplastamiento, secado o contaminación hemática, lo que puede dificultar la identificación de células neoplásicas. Además, su naturaleza limitada (evaluación de sólo una fracción de la muestra) puede subestimar lesiones heterogéneas o focales. En contraste, el estudio anatomopatológico posterior permite el procesamiento de la totalidad del material y la aplicación de técnicas complementarias (inmunohistoquímica, tinciones especiales), lo que aumenta su sensibilidad.
Otro factor clave es la representatividad muestral: mientras el ROSE analiza células dispersas, el examen definitivo puede identificar pequeños agregados celulares o micro fragmentos tisulares con características diagnósticas no evidentes en la citología.
En conclusión, la discordancia refleja las diferencias metodológicas entre ambas técnicas: el ROSE ofrece una aproximación rápida pero limitada a nivel citomorfológico, mientras que el estudio definitivo aporta información más completa y detallada. Esta complementariedad justifica la necesidad de considerar siempre los resultados definitivos para el diagnóstico final, incluso en casos con ROSE inicial negativo o no concluyente.
Solo en 2 casos el análisis AP definitivo informó muestras insuficientes o no aptas para análisis (por presencia de necrosis extensa).
Se realizaron un promedio de 3,9 ± 1,8 pases por adenopatía, tal como lo recomiendan las pautas (al menos 3 pasadas) para optimizar la rentabilidad del procedimiento.2,4,5
El estudio y manejo de los pacientes se lleva a cabo por un equipo multidisciplinario integrado por neumólogos, cirujanos de tórax y oncólogos. En la mayoría de los casos, la decisión de realizar procedimientos como mediastinoscopia, resección atípica, lobectomía o neumonectomía corresponde al cirujano de tórax.
En dos casos, el resultado de las muestras obtenidas por EBUS-TBNA fue discordante al obtenido en la mediastinoscopia: ambos casos correspondieron a linfomas. Justamente en la patología hemato oncológica es donde el rol del diagnóstico mediante muestras citológicas se cuestiona.2 Para el diagnóstico de linfomas, se requiere obtener muestras histológicas. Cuando el linfoma es de baja carga tumoral o de bajo grado puede ser difícil llegar al diagnóstico si la cantidad de tejido obtenida es escasa, o en casos de linfoma de células pequeñas o linfomas poco frecuentes. Estos casos requieren de una gran experticia por parte del patólogo que debe apoyarse en técnicas de inmunohistoquímica o análisis molecular. Sin embargo, poco a poco las muestras citológicas y su procesamiento posterior mediante bloque celular van ganando confianza para el diagnóstico de enfermedades hemato oncológicas.10-12
El análisis de las adenopatías mediastínicas reveló una asociación entre el mayor tamaño ganglionar (≥15 mm) y la etiología maligna (p = 0,0011). (Tablas 5.A y 5.B). Estos hallazgos respaldan el valor del tamaño ecográfico como parámetro predictor de malignidad, aunque su baja sensibilidad (60%) subraya la necesidad de integrarlo con otras herramientas diagnósticas como el PET-TC.6-8
En poco más de la mitad de los casos (51,6%), se solicitó PET-TC como método de estadificación mediastinal no invasiva previa al EBUS. Si bien se ve, desde 2019 a 2023, un aumento del número de pacientes que cuentan PET-TC previo a realizarse el EBUS, aún es un porcentaje bajo el número de pacientes que completan la estadificación trimodal (TC, PET-TC, EBUS), que es la que tiene mejores resultados.3-5
En nuestra serie, el PET -TC mostró una elevada sensibilidad (90%) para el diagnóstico de etiología maligna, siendo 3,75 el valor a partir del cual la asociación es más significativa (S 90%, E 70%), similar a lo descrito en otras series.4
Se presentó como limitación de este trabajo que solo contamos con mediastinoscopia en 4 pacientes, lo cual hace que se pierda la oportunidad de corroborar los resultados del EBUS con un segundo análisis anatomopatológico de la pieza ganglionar completa (gold estándar diagnóstico). Este dato puede ser reflejo de forma indirecta del bajo porcentaje de pacientes que son candidatos a cirugía de resección pulmonar luego de la evaluación diagnóstica y de estadificación: TNM 3 y 4, características tumorales en cuanto a resecabilidad del mismo, insuficiente reserva cardiopulmonar del paciente, voluntad del paciente.12
Los objetivos del trabajo se cumplieron en su totalidad y se lograron resultados con significancia estadística.
Este estudio representa el primer informe de datos de EBUS en Uruguay y diversos aspectos del procedimiento coinciden con hallazgos reportados en la literatura internacional.
Se logró demostrar que el EBUS es una herramienta incluida en la práctica clínica de nuestro centro y que juega un rol principal tanto para la patología benigna como maligna.1,2,12
Uno de los hallazgos a destacar es que el objetivo del procedimiento en la mayoría de los casos fue para realizar diagnóstico y estadificación del CBP en el mismo procedimiento, lo cual permite acortar los tiempos entre diagnóstico y cirugía, y reducir los procedimientos invasivos innecesarios.3,8,10,12
Se ha demostrado una correlación significativa entre el tamaño de las adenopatías, especialmente aquellas con un diámetro ecográfico mayor o igual a 15 mm, y la etiología maligna; así como una asociación entre un valor SUV mayor o igual a 3,75 y la presencia de adenopatías patológicas.
Como fortaleza destacada de nuestra Unidad, contamos con “rapid on site examination” ROSE. Es decir, las muestras de PAAF obtenidas mediante el EBUS son analizadas por médicos anatomopatólogos presentes en la sala de intervenciones lo cual optimiza los tiempos del procedimiento, pudiendo ser de 30 minutos a 1 hora, y reduce el número de punciones en los ganglios en los que que se constata que no hay afectación.4
La gran mayoría de las muestras obtenidas fueron de buena calidad (98,4%) lo que refleja la buena coordinación entre las diferentes disciplinas participantes: médicos y técnicos anatomopatólogos, así como la expertise de los técnicos y médicos broncoscopistas. Asimismo, se ha observado un incremento notable en el número de solicitudes de PET-TC a lo largo del tiempo, lo que refleja una mayor utilización de esta técnica para el estudio de patología mediastinal.4,5
Se enfatiza la importancia de mantener un registro detallado y la revisión sistemática de nuestros propios datos, no solo para comparar con otros centros, sino también para evaluar tendencias futuras, especialmente en lo relacionado con las variantes de la estadificación trimodal. Esto representa un desafío y una oportunidad para mejorar continuamente la calidad de nuestros servicios y la atención a nuestros pacientes.3,12
Financiamiento: los autores declaran que el trabajo no tuvo financiamiento.
Conflictos de interés: los autores declaran que no tienen conflictos de intereses relacionados con el tema de esta publicación.
Contribuciones de los autores: MVI, NT, AB, EQ, NA, AIG: administración del proyecto; análisis formal; conceptualización; curaduría de datos; escritura, revisión y edición; investigación; metodología; recursos; redacción, borrador original; software; supervisión; validación; visualización. LB: curaduría de datos, revisión y edición, redacción, supervisión; validación; visualización.
Los Editores en Jefe, Dres. Carlos Luna y Francisco Arancibia, realizaron el seguimiento del proceso de revisión y aprobaron este artículo.
Referencias
1. Bilal A. Jalil, Kazuhiro Yasufuku & Amir Maqbul Khan. Uses, Limitations, and Complications of Endobronchial Ultrasound. Proc (Bayl Univ Med Cent) 2015;28(3):325-30. Doi: 10.1080/08998280.2015.11929263
2. Wahidi MM, Herth F, Yasufuku K et al. Technical Aspects of Endobronchial Ultrasound-Guided Transbronchial Needle Aspiration: CHEST Guideline and Expert Panel Report. Chest 2016;149(3):816-35. Doi: 10.1378/chest.15-1216.
3. Matilla J. Monografía cáncer de pulmon. Clínica respiratoria SEPAR 2017;6-223.
4. Farsad M. FDG PET/CT in the Staging of Lung Cancer. Curr Radiopharm 2020;13(3):195-203.
5. Herth FJ, Eberhardt R, Krasnik M, Ernst A. Endobronchial ultrasoundguided transbronchial needle aspiration of lymph nodes in the radiologically and positron emission tomography normal mediastinum in patients with lung cancer. Chest 2008;133:887-91. Doi: 10.1378/chest.07-2535.
6. Yasufuku K, Nakajima T, Motoori K et al. Comparison of endobronchial ultrasound, positron emission tomography, and CT for lymph node staging of lung cancer. Chest 2006;130(3):710-8. Doi: 10.1378/chest.130.3.710.
7. Counts S, Kim AW. Diagnostic Imaging and Newer Modalities for Thoracic Diseases. Surgical Clinics Of North America 2017;97(4):733-750.
8. Mazzone PJ, Vachani A, Chang A et al. Quality indicators for the evaluation of patients with lung cancer. Chest 2014;146:659-69. Doi: 10.1378/chest.13-2900.
9. Fielding DI, Kurimoto N. EBUS-TBNA/staging of lung cancer. Clin Chest Med 2013;34(3):385-94. Doi: 10.1016/j.ccm.2013.06.003.
10. Nakajima T, Yasufuku K, Yoshino I. Current status and perspective of EBUS-TBNA. Gen Thorac Cardiovasc Surg 2013;61(7):390-6. Doi: 10.1007/s11748-013-0224-6.
11. Mets O, Smithius R. TNM classification 9th edition. The Radiology Assistant 2025. [Internet]. [Consultado 3 ene 2025]. Disponible en: https://radiologyassistant.nl/chest/lung-cancer/tnm-classification-8th-edition-1
12. Vilmann P, Frost Clementsen P, Colella S et al. Combined endobronchial and esophageal endosonography for the diagnosis and staging of lung cancer: European Society of Gastrointestinal Endoscopy (ESGE) Guideline, in cooperation with the European Respiratory Society (ERS) and the European Society of Thoracic Surgeons (ESTS). Eur J Cardiothorac Surg 2015;48:1–15. Doi: 10.1055/s-0034-1392040