

ARTÍCULO ORIGINAL | Respirar, 2025; 17(2): 149-159 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.17.2.6
Recibido:
9 octubre 2024
Aprobado:
23 abril 2025
Zabert Gustavo E
https://orcid.org/0000-0001-9937-4464
Zabert Ignacio
https://orcid.org/0000-0002-8693-5901
Mariluán Fabian
https://orcid.org/0000-0002-2662-9523
Moran Alfredo
https://orcid.org/0000-0001-7377-5550
Silva Damian
https://orcid.org/0000-0002-2080-5127
Goffredo Diego
https://orcid.org/0000-0003-2333-4954
Mattarucco Walter
https://orcid.org/0000-0002-4861-0655
Grabre Pedro
https://orcid.org/0000-0002-7297-3624
Carles Daniel
https://orcid.org/0000-0002-4273-4630
Bergna Miguel Angel
https://orcid.org/0000-0001-5034-0749
Rovira Francisco
https://orcid.org/0000-0002-8279-3547
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
Utilidad de la escala PUMA electrónica para la detección de EPOC en atención primaria: un estudio de implementación real
Diagnostic Value of PUMA E-Tool in Prospective Case Finding of COPD in Primary Care: A Real-World Implementation Analysis
Gustavo E. Zabert1,2 , Ignacio Zabert1,2
, Ignacio Zabert1,2 , Fabián Mariluán1,2
, Fabián Mariluán1,2 , Alfredo Moran1,3
, Alfredo Moran1,3 , Damián Silva1,4
, Damián Silva1,4 , Diego Goffredo1,5
, Diego Goffredo1,5 , Walter Mattarucco1,6
, Walter Mattarucco1,6 , Pedro Grabre1,7
, Pedro Grabre1,7 , Daniel Carles1,7
, Daniel Carles1,7 , Miguel Angel Bergna1,8
, Miguel Angel Bergna1,8 , Francisco Rovira9
, Francisco Rovira9
1 Asociación Latinoamericana de Tórax.
2 Facultad de Ciencias Médicas UNComahue, Cipolletti, Rio Negro, Argentina.
3 Hospital Alfredo Metraux, Maipú, Mendoza, Argentina.
4 Sistema Integrado de Salud de Tandil, Tandil, Buenos Aires, Argentina.
5 Hospital “V Sanguinetti”, Comodoro Rivadavia, Chubut, Argentina.
6 CEPROSS en San Salvador, Entre Ríos, Argentina.
7 Hospital Perrando de Resistencia, Chaco, Argentina.
8 Hospital Cetrangolo, Buenos Aires, Argentina.
9 Astra Zeneca, Argentina
Autor CORRESPONSAL:
Gustavo E Zabert, gzabert@gmail.com
Resumen
Introducción: La Enfermedad Pulmonar Obstructiva Crónica (EPOC) es una causa principal de morbilidad y mortalidad a nivel global. El subdiagnóstico es frecuente debido a la baja disponibilidad de la espirometría en atención primaria. Por lo tanto, es oportuno implementar una estrategia sencilla y accesible, basada en cuestionarios, para la selección de individuos que requieran de una espirometría diagnóstica.
Métodos: Estudio de corte transversal en cinco centros de atención primaria (CAP) de Argentina con el objetivo de determinar la prevalencia de EPOC en una población de pacientes de alto riesgo y evaluar la utilidad del escore PUMA usando una herramienta electrónica. El tamaño muestral se estimó entre 683 y 893 individuos, considerando una prevalencia entre 20 y 30% con un intervalo de confianza (IC) del 95%.
Resultados: En un periodo de 3 meses, se encuestaron 866 pacientes y 836 que cumplieron criterios de inclusión. El escore PUMA fue ≥ 5 en 503 pacientes y 440 pacientes realizaron espirometría. 63 pacientes fueron excluidos (52 no asistieron a la espirometría, 8 por negativa a participar y 3 por seguridad). Por espirometría, se diagnosticaron 120 casos de EPOC, que representa una prevalencia del 27,3% en la población estudiada y del 23,5% para el subgrupo de pacientes con escore PUMA ≥ 5.
Conclusión: El escore PUMA, integrado en una herramienta electrónica, probó ser una herramienta adecuada para la selección de pacientes para el diagnóstico espirométrico de EPOC en atención primaria.
Palabras clave: EPOC, cuestionario diagnóstico, atención primaria, espirometría, validación, América Latina
Abstract
Background: COPD is a major cause of morbidity and mortality worldwide. Underdiagnosis is frequently reported since spirometry is not widely available in primary care settings. Therefore, a simple and accessible questionnaire-based strategy to select individuals for mandatory spirometry is desirable.
Methods: A cross-sectional study was performed to determine COPD prevalence among high-risk patients in five primary care facilities in Argentina and to assess the utility of PUMA score embedded in an electronic tool. Sample size was estimated between 683 to 893 cases for a prevalence of 20- 30% (with a CI of 95%), respectively.
Results: Over a 3-month period, a total of 866 patients were surveyed, with 836 meeting the inclusion criteria. The PUMA score was ≥ 5 in 503 patients and 440 patients underwent spirometry. Sixty-three patients were excluded (52 did not attend spirometry, 8 refused to participate and 3 for safety reasons). Spirometry diagnosed 120 cases of COPD, representing a COPD prevalence of 27.3% in the study population and 23.5% in the subgroup of patients with a PUMA score ≥ 5.
Conclusion: The PUMA score embedded in an electronic tool performed appropriately to select cases to diagnose COPD by spirometry in a primary care setting.
Keywords: COPD, diagnostic questionnaire, primary care, spirometry, validation, Latin America
Introducción
La enfermedad pulmonar obstructiva crónica (EPOC) representa un creciente problema de salud global, erigiéndose como una de las principales causas de morbilidad y mortalidad a nivel mundial.1,2 Actualmente, constituye la cuarta causa de muerte1 y se proyecta ascender a la tercera posición para el año 2030, con una estimación de 3,17 millones de decesos anuales.3,4 La prevalencia estimada de EPOC en individuos de 65 años o más alcanza el 14,2% (IC 95%: 11-18%), en contraste con el 9,9% (IC 95%: 8,2-11,8%) observado en la población de 40 años o más.5,6
A nivel global, la prevalencia de EPOC exhibe una considerable variabilidad, con tasas de infradiagnóstico que oscilan entre el 10% y el 95%, y de sobrediagnóstico entre el 5% y el 60%.7 Dado que suele cursar asintomática en sus fases iniciales y que su diagnóstico requiere de confirmación espirométrica de la obstrucción de la vía aérea por espirometría, el infradiagnóstico y el diagnóstico erróneo son frecuentes, especialmente en las etapas tempranas de la enfermedad.8 Diversos estudios indican que el subdiagnóstico de la EPOC se asocia con el sexo masculino, menor edad y bajo nivel educativo, no haber fumado nunca o ser exfumador, sin espirometrías previas y menor obstrucción al flujo aéreo.9 La subutilización de la espirometría, especialmente en atención primaria, es un factor clave en este problema.10,11
A pesar de ser una herramienta diagnóstica fundamental para la EPOC, la espirometría enfrenta limitaciones en la atención primaria debido al acceso restringido a los equipos y a la falta de pericia en su ejecución e interpretación.11 La pandemia de COVID-19, con el consiguiente riesgo de transmisión del SARS-CoV-2, supuso un nuevo y considerable impedimento para la realización de esta prueba.12,13 Además, el subdiagnóstico de la EPOC en la comunidad puede deberse a que las definiciones basadas en eventos a menudo no evalúan los síntomas de forma adecuada.14 La identificación temprana y precisa de EPOC en pacientes de alto riesgo en un entorno primario es esencial para desarrollar e implementar estrategias de tratamiento eficaces.
La implementación de un cribado selectivo en pacientes de atención primaria con factores de riesgo y sintomatología compatible con EPOC tiene el potencial de optimizar significativamente las tasas de diagnóstico temprano. Asimismo, la detección oportunista permite extender este beneficio a la identificación de individuos de alto riesgo, independientemente de su presentación clínica actual.15 El estudio PUMA desarrolló y validó previamente un cuestionario, basado en la búsqueda oportunista de casos en atención primaria, para identificar a pacientes con EPOC de alto riesgo. Esta herramienta ha sido rigurosamente validada utilizando extensas bases de datos de EPOC.16
Este estudio prospectivo de búsqueda de casos en el mundo real exploró la prevalencia de EPOC en una población de atención primaria utilizando un enfoque de dos pasos: el escore PUMA, integrado en una herramienta electrónica, para seleccionar pacientes para la espirometría diagnóstica.
Métodos
Diseño
Estudio transversal, prospectivo, de búsqueda de casos, que seleccionó activamente pacientes de alto riesgo para espirometría en un entorno de atención primaria de salud de mundo real. El estudio se desarrolló en cinco centros de atención primaria de salud de Argentina entre octubre y diciembre de 2018 (primavera del hemisferio sur): Maipú (Mendoza), Tandil (Buenos Aires), Comodoro Rivadavia (Chubut), San Salvador (Entre Ríos) y Resistencia (Chaco). La aprobación de los aspectos éticos de la investigación fue otorgada por el Comité de Docencia e Investigación de la Clínica Pasteur (Estudio Puma 002-1-123-2018) y por el Comité de Investigación de Comodoro Rivadavia (Nro. 60/2018-folio 122), siendo este último el único centro que no se acogió a la aprobación centralizada. Todos los participantes proporcionaron su consentimiento informado por escrito.
Población del estudio
Los participantes fueron reclutados por sus médicos durante las visitas de rutina a su consultorio en los centros de atención primaria (CAP). Los pacientes elegibles debían ser mayores de 40 años y tener antecedentes de tabaquismo de 10 o más paquetes-año (actual o anterior). Los criterios de exclusión incluyeron embarazo; contraindicaciones para la espirometría (específicamente, cirugía torácica, abdominal o neurológica; síndrome coronario agudo; desprendimiento de retina; hospitalización por problemas cardíacos en los últimos 3 meses; o una frecuencia cardíaca ≥120 lpm en el momento de la espirometría); cualquier condición física o mental que impidiera completar el estudio; tuberculosis activa o infección respiratoria aguda; y participación activa en un ensayo clínico. Los sujetos inscritos debían otorgar su consentimiento informado.
Proceso de selección
Los médicos de atención primaria aplicaron el cuestionario PUMA de siete ítems (sexo, edad, paquetes-año de tabaquismo, disnea, producción de esputo, tos y antecedentes de espirometría), en forma sistemática a todos sus pacientes para la identificación de potenciales casos de EPOC. Las respuestas de los pacientes fueron registradas a través de la plataforma RedCap (Universidad de Vanderbilt, 2004) de ALAT mediante dispositivos móviles (teléfonos inteligentes y tabletas). A aquellos pacientes con una puntuación PUMA igual o superior a 5 se les asignó una cita para espirometría in situ con el fin de confirmar el diagnóstico de EPOC.
Espirometría
La espirometría se realizó con un espirómetro ultrasónico (EasyOne® de NDD Technopark, Zúrich, Suiza) al inicio y 15 minutos después de la administración de un broncodilatador (salbutamol inhalado 400 μg). Técnicos capacitados en todos los centros siguieron los criterios de la ATS/ERS y el protocolo del estudio PUMA (versión 1.5, 30 de octubre de 2018). La aceptabilidad y reproducibilidad de la espirometría se determinaron según los criterios de la ATS (mínimo 8, máximo 15 maniobras). Las pruebas se realizaron en posición sentada con pinzas nasales. Se implementó una verificación de calidad de datos de dos niveles (por parte del personal del centro antes del ingreso en la base de datos y de forma centralizada dentro de las 24 horas posteriores a la entrada). Los datos se categorizaron según las directrices estandarizadas de informes de función pulmonar de la ATS/ERS, con mediciones complementarias para garantizar la calidad.
Resultados
El desenlace primario del estudio fue la prevalencia de EPOC, definida como un cociente FEV1/FVC <0,7. El desenlace secundario fue la proporción de pacientes con un escore PUMA ≥ a 5.
Análisis estadístico
El tamaño de la muestra se estimó utilizando Epi Info versión 8.0 (Centros para el Control y la Prevención de Enfermedades), con base en los datos de prevalencia de EPOC del estudio PUMA (que oscilan entre el 20% en Venezuela y el 30% en Argentina). Con un límite de confianza del 3% y un efecto de diseño de 1, el tamaño de la muestra estimado osciló entre 683 (prevalencia del 20%) y 893 (prevalencia del 30%) para un intervalo de confianza del 95%. Los estadísticos descriptivos se presentan como frecuencias absolutas y relativas. Los análisis se realizaron con Stata 13.1 (StataCorp, College Station, TX). Se utilizaron las pruebas de Mann-Whitney y de chi-cuadrado para comparar variables continuas y categóricas, respectivamente, con una significación estadística < 0,05.
Resultados
Características basales
Entre noviembre y diciembre de 2018, 866 participantes dieron su consentimiento para participar en el estudio y completar el cuestionario. Treinta participantes fueron excluidos posteriormente por las siguientes razones: no fumador (n=1), edad <40 años (n=4), historial de tabaquismo <10 paquetes-año (n=17), registros duplicados (n=7) y datos incompletos (n=1). (Figura 1).
Figura 1.
Diagrama de flujo del estudio
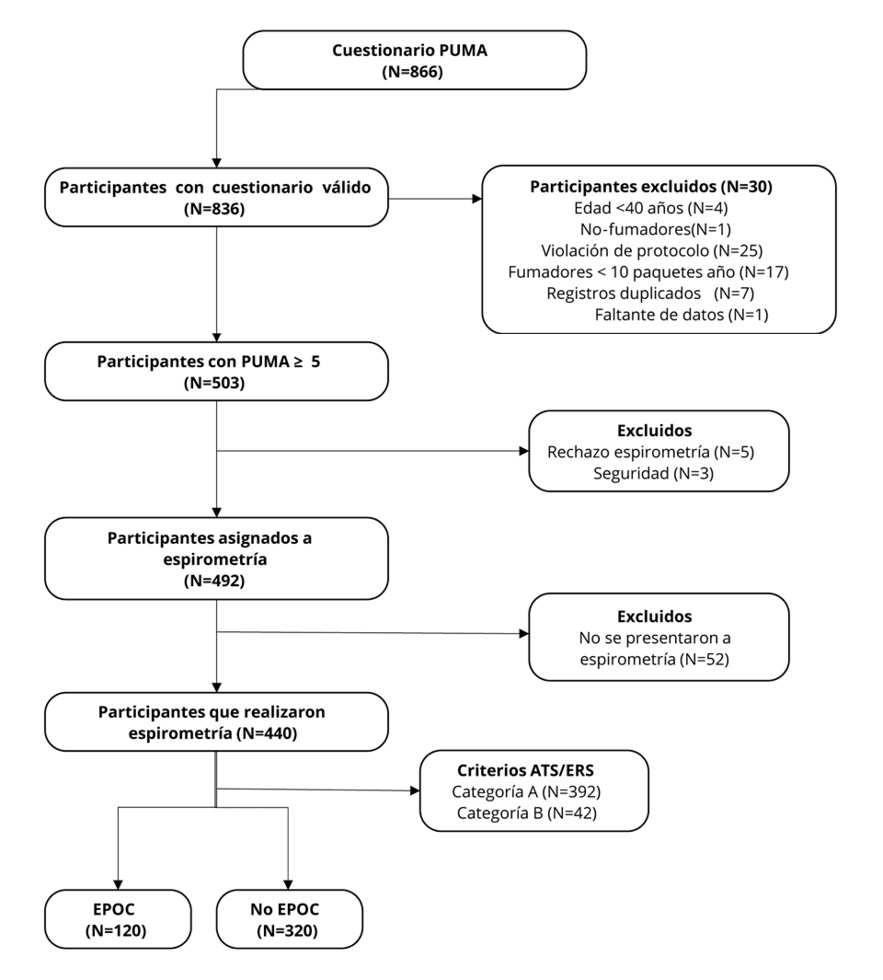
Las características basales de los 836 participantes con encuestas válidas se presentan en la Tabla 1. La edad promedio de los participantes fue de 57,4 ± 10,4 años, con una muestra predominantemente masculina (53,9%). Un 38,6% de los participantes refirió historia de espirometría previa, lo que resultó en que el 60,1% presentara escore PUMA ≥ a 5 (Tabla 1).
De los 503 participantes iniciales, 492 (97,81%) fueron citados para una espirometría. Once participantes rechazaron realizar el procedimiento y no fueron citados. Aproximadamente el 10% de los citados no se presentó a la prueba, lo que resultó en 440 participantes (91,47%) con resultados válidos de espirometría. Según los criterios de la ATS/ERS, 392 participantes (89%) calificaron para la categoría A y 41 participantes (9%) para la categoría B. (Figura 1).
Tabla 1.
Características demográficas de la población (Total N=836)
|
N=836 |
95% CI |
|
|
Medidas |
||
|
Edad (años completos), media ± S |
57,46 ±10,42 |
|
|
Cigarrillos por día, media ± SD |
22,19 ±11,63 |
|
|
Años de fumador, media ± SD |
31,72 ±11,39 |
|
|
Paquetes año fumados de vida, media ± SD |
34,64 ±22,36 |
|
|
Demografía |
||
|
Masculino, n (%) |
451 (53,9) |
51,6 -58,4 |
|
Características de salud |
||
|
Disnea, n (%) |
458 (54,7) |
52,5-59,4 |
|
Tos crónica, n (%) |
386 (46,1) |
43,8-50,6 |
|
Flema crónica, n (%) |
352 (42,1) |
39,7-46,6 |
|
Espirometria previa en la vida, n% |
323 (38,6) |
36,2-42,9 |
|
Escore PUMA ≥ 5, n (%) |
503 (60,1) |
56,8-62,4 |
Análisis del escore PUMA
Según las respuestas de la encuesta, 503 participantes obtuvieron una puntuación PUMA ≥ a 5, mientras que en 333 participantes fue inferior a 5. El análisis de las variables PUMA reveló diferencias estadísticamente significativas entre ambos grupos (p<0,0001). (Tabla 2).
Tabla 2.
Características basales de los pacientes en individuos con puntuación PUMA ≥ 5 (n = 503) y< 5 (n = 333)
|
PUMA ≥ 5 n=503 |
PUMA < 5 n=333 |
valor de p |
|
|
Medidas |
|||
|
Edad (años completos), media ± S |
59,58 ± 9,75 |
54,4 ± 10,72 |
<0,0001 |
|
Cigarrillos por día, media ± SD |
25,24 ± 12,24 |
16,83 ± 8,71 |
<0,0001 |
|
Años de fumador, media ± SD |
34,79 ± 10,96 |
26,15 ± 10,90 |
<0,0001 |
|
Paquetes año fumados de vida, media ± SD |
42,69 ± 23,35 |
20,87 ± 12,87 |
<0,0001 |
|
Demografía |
|||
|
Masculino, n (%) |
309 (61,4) |
150 (45,0) |
<0,0001 |
|
Características de salud |
|||
|
Disnea, n (%) |
366 (72,7) |
92 (29,3) |
<0,0001 |
|
Tos crónica, n (%) |
319 (63,4) |
67 (21,3) |
<0,0001 |
|
Flema crónica, n (%) |
301 (59,9) |
51 (16,3) |
<0,0001 |
|
Espirometria previa en la vida, n (%) |
261 (51,9) |
62 (19,7) |
<0,0001 |
Prueba de c2 para variables categóricas y prueba de Mann-Whitney para variables continuas
Análisis de espirometría
La Tabla 3 presenta un análisis de subgrupos de participantes con una puntuación PUMA de 5 o superior, estratificados según el diagnóstico de EPOC confirmado por espirometría (EPOC, n = 120; sin EPOC, n = 320). Las variables que se asociaron significativamente con el diagnóstico de EPOC fueron edad (58,2 vs. 62,7 años, p < 0,0001), los años de tabaquismo (33,4 vs. 39,2 años, p < 0,0001), los paquetes-año (40,8 vs. 48,9 años, p < 0,0001), la disnea (69,1% vs. 80%, p = 0,02), la flema crónica (56,4% vs. 69,2%, p = 0,01) y la espirometría previa (50,9% vs. 61,7%, p = 0,04). Por el contrario, género (p=0,57), tos crónica (p=0,42) y cigarrillos por día (p=0,64) no se asociaron con el diagnóstico de EPOC. (Tabla 3).
Tabla 3.
Características de los pacientes en individuos con PUMA ≥ 5 (n = 440 en total) con EPOC (VEF1er/CVF posbroncodilatador < 0,70, n = 120) y sin la afección (n = 320)
|
No EPOC n=320 |
EPOC n=120 |
valor de p |
|
|
Medidas |
|||
|
Edad (años completos), media ± SD |
58,27± 9,68 |
62,75 ± 9,46 |
1 |
|
Cigarrillos por día, media ± SD |
25,25 ±12,38 |
25,07 ±11,05 |
0,64 |
|
Años de fumador, media ± SD |
33,43 ± 10,64 |
39,23 ± 10,13 |
<0,0001 |
|
Paquetes año fumados de vida, media ± SD |
40,80 ± 22,45 |
48,93 ± 24,89 |
<0,0001 |
|
Demografía |
|||
|
Masculino, n (%) |
196 (61,2%) |
70 (58,3) |
0,57 |
|
Características de salud |
|||
|
Disnea, n (%) |
221 (69,1) |
96 (80,0) |
0,02 |
|
Tos crónica, n (%) |
200 (62,5) |
80 (66,7) |
0,42 |
|
Flema crónica, n (%) |
180 (56,4) |
83 (69,2) |
0,01 |
|
Espirometria previa en la vida, n (%) |
163 (50,9) |
74 (61,7) |
0,04 |
Prueba de c2 para variables categóricas y prueba de Mann-Whitney para variables continuas
Tabla 4.
Análisis comparativo del valor diagnóstico de las herramientas de detección de la EPOC y el cuestionario PUMA
|
Autor |
Escore |
n |
Prevalencia EPOC |
Punto de Corte |
AUC ROC |
Sensibilidad |
Especificidad |
PPV |
NPV |
Precisión |
|
Spyratos et al.23 |
IPAG |
3234 |
10,9% |
≥17 |
0,8 |
74% |
72% |
24% |
96% |
72% |
|
COPD-PS |
≥5 |
0,79 |
56% |
90% |
41% |
94% |
86% |
|||
|
LFQ |
≤ 18 |
0,8 |
79% |
68% |
23% |
96% |
69% |
|||
|
Bergna et al.27 |
CODE |
468 |
20,5% |
≥4 |
0,67 |
56% |
72,1% |
34% |
86% |
69% |
|
López Varela et al.28 |
PUMA |
1540 |
20,1% |
≥5 |
0,76 |
74% |
65% |
35% |
91% |
76% |
Análisis de sensibilidad
Con el objetivo de mitigar el potencial sesgo de selección inherente al diseño multicéntrico en un entorno real y a la estrategia de reclutamiento competitivo, se exploraron tres modelos de regresión logística. Estos modelos incluyeron la puntuación PUMA, el centro de atención primaria (CAP) como variable categórica, la calidad de la espirometría y la edad como variable continua. La puntuación PUMA se mantuvo significativamente asociada al diagnóstico de EPOC.
Discusión
Este estudio se llevó a cabo en entornos sanitarios reales, no en un entorno de investigación controlado. Este enfoque de búsqueda de casos aportó información valiosa para estrategias eficaces de salud pública, especialmente beneficiosas para los sistemas de salud de los países en desarrollo. A diferencia de los países desarrollados con un mayor PIB per cápita, los países de ingresos bajos y medios suelen encontrar dificultades para desarrollar e implementar programas eficaces de detección y diagnóstico temprano de enfermedades crónicas, lo que provoca retrasos en el acceso oportuno a la atención.29 La crisis sanitaria derivada de la pandemia de la enfermedad por coronavirus de 2019 (COVID-19) ha comprometido significativamente la atención efectiva de los pacientes con EPOC.12
La pandemia de COVID-19 ha afectado significativamente el funcionamiento de los laboratorios de pruebas de función pulmonar. Debido al riesgo de transmisión viral, los laboratorios han experimentado restricciones operativas y un aumento de costos. Estos factores podrían provocar un mayor subdiagnóstico de la EPOC y por ende limitar el tratamiento adecuado para pacientes no diagnosticados.13 La estrategias basadas en pacientes de alto riesgo podrían constituir una herramienta valiosa y costo-efectiva para el triaje o como complemento de las estrategias diagnósticas en contextos de recursos limitados, especialmente durante la pandemia de COVID-19. El escore PUMA, implementado a través de una herramienta electrónica, demostró un valor diagnóstico comparable al del estudio original, lo que sugiere su potencial como una alternativa útil en entornos clínicos.16
Varios autores han propuesto el cribado de poblaciones de alto riesgo mediante cuestionarios o mediciones simplificadas de la función pulmonar. Diversos grupos han desarrollado cuestionarios para ayudar a los médicos a identificar a los pacientes aptos para la espirometría diagnóstica. (Tabla 4).
Calverly et al. desarrollaron una herramienta de detección basada en la población, validada retrospectivamente utilizando datos de la National Health and Nutrition Examination Survey (NHANES III), que demostró una sensibilidad del 85%, una especificidad del 45%, un valor predictivo positivo (VPP) del 38% y un valor predictivo negativo (VPN) del 88%.18 De forma similar, Price et al. crearon el escore internacional Primary Care Airways Group (IPAG) que emplea dos puntos de corte para estratificar a los pacientes en zonas de riesgo alto, medio y bajo de obstrucción de las vías respiratorias. El sistema IPAG reportó sensibilidades que oscilaban entre el 54% y el 82%, especificidades entre el 58% y el 88%, valores predictivos positivos (VPP) entre el 30% y el 78%, y valores predictivos negativos (VPN) entre el 71% y el 93%.19
Martínez et al. describieron un cuestionario autoadministrado de 7 ítems, COPD Population Screener (COPD-PS), en una población con una prevalencia del 38,5% de FEV1/FVC < 70%. Una puntuación de 5 o más en el COPD-PS arrojó un valor predictivo positivo (VPP) del 56,8% y un valor predictivo negativo (VPN) del 86,4%.20
Yawn et al., utilizando datos de adultos del NHANES III con bronquitis crónica declarada, desarrollaron y validaron un Cuestionario de Función Pulmonar (LFQ) de 5 ítems. El LFQ mostró un área bajo la curva (AUC) de 0,720, una sensibilidad del 73,2% y una especificidad del 58,2%.21
Llamativamente, Spyratos et al. informaron valores de AUC similares (0,794-0,809) y VPN alto (>96%) en los tres cuestionarios en sujetos con un diagnóstico de enfermedad respiratoria distinta de EPOC, sugiriendo una capacidad discriminatoria general comparable en identificación de individuos de bajo riesgo.23
Todos los cuestionarios identificaron como variables predictoras de EPOC a la edad, los paquetes-año, la tos, la disnea y la flema, correlacionados con el diagnóstico confirmado por espirometría. A pesar de estas similitudes, se observaron diferencias operativas sustanciales. Este hecho probablemente se deba a que los instrumentos utilizados se diseñaron en diferentes escenarios, lo que afectó inherentemente a su precisión. Además, que la prevalencia de EPOC en las poblaciones estudiadas influyó en el VPP y el VPN.
Hanania et al. validaron el LFQ autoadministrado en una población de atención primaria en Kentucky con una prevalencia de EPOC del 18,6% con AUC ROC=0,652; sensibilidad del 82,6%; especificidad del 47,8% y el 54,3% de casos de EPOC fueron clasificados correctamente.22
El Cuestionario de diagnóstico de EPOC (CDQ), administrado en 36 centros de atención primaria en toda Australia e informado por Stanley et al., demostró una precisión insuficiente para discriminar entre pacientes con y sin EPOC definida por espirometría.24 Frith et al. y Franco-Marina et al. recomendaron el uso de la medición del FEV1/FEV6 dentro de los protocolos de detección de la EPOC en entornos de atención primaria, y sugirieron un rendimiento superior al de los cuestionarios de EPOC solos.25,26 Siguiendo las recomendaciones del US Preventive Services Task Force de EE. UU. contra el cribado de la EPOC en adultos asintomáticos, Barnes et al. propusieron un método de detección de casos específico de tres pasos. Este método utiliza un cuestionario de EPOC para el cribado inicial, seguido de la medición del pico espiratorio de flujo (PEF) con un dispositivo electrónico en un segundo paso, para identificar a las personas con una alta probabilidad pre-test de EPOC moderada a grave.27
Para identificar posibles casos de EPOC, Bergna et al. desarrollaron una escala de respuesta binaria simple de 6 ítems llamada Cuestionario de Detección de EPOC (CODE). La escala fue administrada por profesionales de la salud a pacientes consecutivos mayores de 40 años con antecedentes de tabaquismo ≥10 paquetes-año, que acudían a hospitales participantes por causas no respiratorias y sin diagnóstico previo de asma, EPOC ni ninguna enfermedad respiratoria grave. Los resultados diagnósticos reportados incluyeron un AUC ROC de 0,67 y, con un punto de corte de 4 puntos, una sensibilidad del 56,2%, una especificidad del 72,1%, un VPP del 34,4%, un VPN del 86,4% y una precisión diagnóstica del 68,8%.28
López-Varela et al. desarrollaron y validaron el escore PUMA, un cuestionario de siete ítems, para evaluar el riesgo de EPOC en una población de varios países de latinoamérica.16 Mediante el índice de Youden, se establecieron puntos de corte óptimos: ≥5 puntos para la escala simple y ≥25 puntos para el modelo ponderado. Ambos modelos mostraron un rendimiento diagnóstico comparable con valores predictivos negativos (VPN) del 90,9% y 92,1%, respectivamente, y un número necesario a cribar (NNS) de 4 y 3. La validación posterior en las bases de datos PLATINO y del Hospital Maciel respaldó aún más la eficacia de la escala.28
Este estudio evalúa la aplicación práctica del escore PUMA, integrada en una plataforma de investigación desde dispositivos electrónicos, para guiar la prescripción de espirometría para la detección de EPOC en atención primaria y en entornos del mundo real; con la hipótesis de que la integración de la tecnología mejorará la accesibilidad. ALAT tiene disponible el desarrollo de una app para ser usada en teléfonos inteligentes o tabletas electrónicas.
Fortalezas y limitaciones
La administración de la puntuación PUMA mediante un cuestionario electrónico en teléfonos inteligentes y tabletas garantizó altas tasas de respuesta de los participantes. Una estrategia de reclutamiento competitivo permitió que cada centro operara a plena capacidad, y lograra el tamaño de muestra determinado a partir de estudios epidemiológicos sobre EPOC publicados. Este diseño multicéntrico facilitó la captura de muestras regionales y minimizó el sesgo de selección, y así proporcionó una validación externa de informes previos, en consonancia con la implementación práctica en atención primaria.
Aunque los criterios de inclusión fueron similares al reporte PUMA, el presente estudio presenta varias limitaciones que merecen consideración.16 En primer lugar, a pesar de utilizar criterios de inclusión análogos al estudio PUMA original de 2016, observamos diferencias en la distribución de género, edad y paquetes de cigarrillos-año al comparar las características basales de ambos estudios. Esta discrepancia podría atribuirse a las diferencias demográficas entre los estudios. El estudio PUMA incluyó una población de grandes centros urbanos y una proporción significativa de jubilados, mientras que nuestro estudio se centró en una población comparativamente más activa de ciudades más pequeñas. En segundo lugar, debido a la falta de datos de espirometría de los participantes con una puntuación PUMA < 5, no pudimos analizar la relación entre el escore PUMA y la espirometría en este grupo. Además, la estrategia de reclutamiento adoptada introduce un posible sesgo de selección. El enfoque competitivo podría haber dado lugar a un rendimiento heterogéneo de los centros, ya que estos podrían haber empleado un muestreo por conveniencia para maximizar la inscripción de participantes. La duración relativamente corta del estudio, concretamente durante la primavera, también podría haber contribuido a este sesgo. Además, la presencia de un neumólogo de referencia en cada centro podría haber influido en el comportamiento de cribado en los médicos de atención primaria (MAP). Por último, el diseño del estudio, limitado por un cuestionario centrado en EPOC por el tabaco, limita la representación de pacientes con EPOC inducida por biomasa u otras causas, lo que podría afectar la generalización de los hallazgos a esta población.
Conclusiones
En nuestro conocimiento, este es el primer informe de implementación que demuestra el valor de una herramienta electrónica para el cribado de la EPOC en pacientes de alto riesgo en atención primaria, en un escenario real en latinoamérica. El diagnóstico precoz podría mejorar la atención de los casos sin diagnóstico de EPOC. El estudio valida aún más la eficacia de la puntuación PUMA para el cribado de la EPOC relacionada con el tabaco, como lo demuestran 120 casos confirmados por espirometría de 503 pacientes con una puntuación PUMA ≥ 5 (estimada en 123 casos). La implementación de la puntuación PUMA a través de esta herramienta electrónica resultó sencilla, rápida, asequible y accesible, y facilitó la recopilación de datos para la espirometría diagnóstica y el seguimiento posterior.
Financiamiento: financiación de AstraZeneca Pharmaceutical LP a través de una subvención a ALAT. El financiador no tuvo ningún papel en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito. Kirtika Verma PHD, del Indian Institute of Technology en Delhi, brindó apoyo para la redacción en idioma inglés a partir del manuscrito original traducido del español por el autor principal, y con financiamiento de los fondos de subvención AstraZeneca.
Conflictos de interés: GZ: ha recibido honorarios como speaker de AstraZeneca, Boehringer Ingelheim, GSK & Abbott. IZ: ha recibido honorarios como disertante y para asistencia a conferencias científicas de las empresas GSK, Sanofi, AstraZeneca, Tuteur. DHG: ha recibido honorarios como disertante y recursos logísticos para asistir a conferencias científicas de las empresas GSK, Boehringer Ingelheim, AstraZeneca. DC: ha recibido apoyo logístico para asistir a eventos promocionales de Astra Zeneca, Boehringer Ingelheim y GSK. WM: en los últimos 3 años ha asistido a eventos promocionales de distintas industrias Astra Zeneca, Boehringer Ingelheim y GSK. Ha recibido dinero por reclutamiento de pacientes o por llevar a cabo investigaciones, incluso si no tienen relación con el tema del manuscrito, de las empresas Novartis, Astra Zeneca, Hoffman Roche. Ha recibido honorarios como speaker de Astra Zeneca. MAB: participa como investigador principal en estudios de farmacología clínica. FR: trabajó como Medical Advisor en Astra Zeneca desde septiembre 2016 hasta febrero 2022. Durante ese período se desarrollaron y apoyaron numerosas iniciativas para generar datos de la vida real relacionados a la atención del paciente con asma, asma grave, EPOC y pacientes con enfermedades respiratorias.
Contribuciones de los autores: GEZ: administración del proyecto; adquisición de fondos, conceptualización; curaduría de datos; metodología; recursos, redacción, borrador original; escritura, revisión y edición; y supervisión. IZ: conceptualización; metodología; análisis formal, curaduría de datos; software; supervisión; validación; redacción, borrador original; escritura, revisión y edición; y supervisión. MF: curaduría de datos; software; supervisión; validación. AM: investigación; escritura, revisión y validación y supervisión. DS: investigación; revisión y validación. DG: investigación; revisión y validación. WM: investigación; revisión y validación. PG: investigación; revisión y validación. DC: investigación; revisión y validación. MAB: conceptualización, metodología; revisión y validación. FR: adquisición de fondos, conceptualización, recursos; visualización; revisión; validación.
El Editor Adjunto, Dr. Rogelio Pérez Padilla, realizó el seguimiento del proceso de revisión y este editor, junto con los editores en jefe, Dres. Carlos Luna y Francisco Aranciabia aprobaron este artículo.
Referencias
1. Mannino DM, Kiri VA. Changing the burden of COPD mortality. Int J COPD 2006;1(3):219-233. Doi:10.2147/copd.2006.1.3.219
2. Izquierdo JL, Barcina C, Jiménez J, Muñoz M, Leal M. Study of the burden on patients with chronic obstructive pulmonary disease. Int J Clin Pract 2009;63(1):87-97. Doi:10.1111/j.1742-1241.2008.01936.x
3. WHO. Chronic obstructive pulmonary disease (COPD). Burden of COPD. [Internet]. [Consultado 10 nov 2024]. Disponible en: https://www.who.int/news-room/fact-sheets/detail/chronic-obstructive-pulmonary-disease-(copd)
4. Halbert RJ, Natoli JL, Gano A, Badamgarav E, Buist AS, Mannino DM. Global burden of COPD: systematic review and meta-analysis. Eur Respir J 2006;28(3):523-532. Doi:10.1183/09031936.06.00124605
5. Berry CE, Wise RA. Mortality in COPD: causes, risk factors, and prevention. COPD. 2010;7(5):375-82. Doi: 10.3109/15412555.2010.510160
6. Boers E, Barrett M, Su JG et al. Global Burden of Chronic Obstructive Pulmonary Disease Through 2050. JAMA Netw Open 2023;6(12):e2346598. Doi: 10.1001/jamanetworkopen.2023.46598
7. Ho T, Cusack RP, Chaudhary N, Satia I, Kurmi OP. Under-and over-diagnosis of COPD: A global perspective. Breathe 2019;15(1):24-35. Doi:10.1183/20734735.0346-2018
8. Schiavi E, Stirbulov R, Hernández Vecino R et al. COPD screening in primary care in four Latin American countries: Methodology of the PUMA study. Arch Bronconeumol 2014;50(11). Doi:10.1016/j.arbres.2014.03.006
9. Diab N, Gershon AS, Sin DD et al. Underdiagnosis and Overdiagnosis of Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med 2018;198(9):1130-1139. Doi:10.1164/rccm.201804-0621CI
10. Lamprecht B, Soriano JB, Studnicka M et al. Determinants of Underdiagnosis of COPD in National and International Surveys. Chest 2015;148(4):971-985. Doi:10.1378/chest.14-2535
11. Hangaard S, Helle T, Nielsen C, Hejlesen OK. Causes of misdiagnosis of chronic obstructive pulmonary disease: A systematic scoping review. Respir Med 2017;129:63-84. Doi:10.1016/j.rmed.2017.05.015
12. Halpin DMG, Criner GJ, Papi A et al. Global Initiative for the Diagnosis, Management, and Prevention of Chronic Obstructive Lung Disease. The 2020 GOLD Science Committee Report on COVID-19 and Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med 2021;203(1):24-36. Doi:10.1164/rccm.202009-3533SO
13. Gochicoa-Rangel L, Torre-Bouscoulet L, Salles Rojas A et al. Functional Respiratory Evaluation in the COVID-19 Era: The Role of Pulmonary Function Test Laboratories. Rev Investig Clin 2020;1-6. Doi:10.24875/ric.20000250
14. Langsetmo L, Platt RW, Ernst P, Bourbeau J. Underreporting Exacerbation of Chronic Obstructive Pulmonary Disease in a Longitudinal Cohort. Am J Respir Crit Care Med 2008;177(4):396-401. Doi:10.1164/rccm.200708-1290OC
15. Jordan RE, Lam KBH, Cheng KK et al. Case finding for chronic obstructive pulmonary disease: A model for optimizing a targeted approach. Thorax 2010;65(6):492-498. Doi:10.1136/thx.2009.129395
16. López Varela MV, Montes de Oca M, Rey A, Casas A, Stirbulov R, Di Boscio V. Development of a simple screening tool for opportunistic COPD case finding in primary care in Latin America: The PUMA study. Respirology 2016;21:1227-1234. Doi:10.1111/resp.12834
17. Culver BH, Graham BL, Coates AL et al. Recommendations for a Standardized Pulmonary Function Report. An Official American Thoracic Society Technical Statement. Am J Respir Crit Care Med 2017;196(11):1463-1472. Doi:10.1164/rccm.201710-1981ST
18. Calverley PMA, Nordyke RJ, Halbert RJ, Isonaka S, Nonikov D. Development of a population-based screening questionnaire for COPD. COPD 2005;2(2):225-232.
19. Price DB, Tinkelman DG, Nordyke RJ, Isonaka S, Halbert RJ. Scoring System and Clinical Application of COPD Diagnostic Questionnaires. Chest 2006;129(6):1531-1539. Doi:10.1378/chest.129.6.1531
20. Martinez FJ, Raczek AE, Seifer FD et al. Development and initial validation of a self-scored COPD population screener questionnaire (COPD-PS). COPD J Chronic Obstr Pulm Dis 2008;5(2):85-95. Doi:10.1080/15412550801940721
21. Yawn BP, Mapel DW, Mannino DM et al. Development of the lung function questionnaire (LFQ) to identify airflow obstruction. Int J COPD 2010;5(1):1-10.
22. Hanania NA, Mannino DM, Yawn BP et al. Predicting risk of airflow obstruction in primary care: Validation of the lung function questionnaire (LFQ). Respir Med 2010;104(8):1160-1170. Doi:10.1016/j.rmed.2010.02.009
23. Spyratos D, Haidich AB, Chloros D, Michalopoulou D, Sichletidis L. Comparison of Three Screening Questionnaires for Chronic Obstructive Pulmonary Disease in the Primary Care. Respiration 2017;93(2):83-89. Doi:10.1159/000453586
24. Stanley AJ, Hasan I, Crockett AJ, van Schayck OCP, Zwar NA. Validation of the COPD diagnostic questionnaire in an Australian general practice cohort: A cross-sectional study. Prim Care Respir J 2014;23(1):92-97. Doi:10.4104/pcrj.2014.00015
25. Frith P, Crockett A, Beilby J et al. Simplified COPD screening: Validation of the PiKo-6® in primary care. Prim Care Respir J 2011;20(2):190-198. Doi:10.4104/pcrj.2011.00040
26. Franco-Marina F, Fernandez-Plata R, Torre-Bouscoulet L et al. Efficient screening for COPD using three steps: a cross-sectional study in Mexico City. NPJ Prim Care Respir Med 2014;24:14002. Doi: 10.1038/npjpcrm.2014.2.
27. Barnes T, Fromer L. Spirometry use: detection of chronic obstructive pulmonary disease in the primary care setting. Clin Interv Aging 2011;47. Doi:10.2147/CIA.S15164
28. Bergna MA, García GR, Alchapar R et al. Development of a simple binary response questionnaire to identify airflow obstruction in a smoking population in Argentina. Eur Respir Rev 2015;24(136):320-326. Doi: 10.1183/16000617.00005214
29. López Varela MV, Montes De Oca M, Wehrmeister FC, Rodriguez C, Ramirez L, Menezes A. External validation of the PUMA COPD diagnostic questionnaire in a general practice sample and the PLATINO study population. Int J Chron Obstruct Pulmon Dis 2019; 14:1901-1911. Doi:10.2147/COPD.S206250
30. Aaron SD, Vandemheen KL, Whitmore GA et al. Early Diagnosis and Treatment of COPD and Asthma — A Randomized, Controlled Trial. N Eng J Med 2024;390(22):2061-2073. Doi:10.1056/nejmoa2401389.