

ARTÍCULO ORIGINAL | Respirar, 2025; 17(2): 129-138 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.17.2.4
Rodolfo Fuertes Mamani
https://orcid.org/0009-0009-4341-6974
Leslie Navia Ortuño
https://orcid.org/0000-0002-1075-7942
Recibido:
19 septiembre 2024
Aprobado:
18 febrero 2025
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
Rendimiento diagnóstico del Genexpert ultra en lavado broncoalveolar para tuberculosis pulmonar, Hospital Luis Uría de la Oliva
Diagnostic Performance of Genexpert Ultra in Bronchoalveolar Lavage for
Pulmonary Tuberculosis, Hospital Luis Uría de la Oliva
Rodolfo Fuertes Mamani1 , Leslie Navia Ortuño2
, Leslie Navia Ortuño2
1 Hospital Luis Uría de la Oliva, Unidad de Broncoscopia y Neumología, La Paz, Bolivia.
2 Hospital Oncológico Caja Nacional de Salud, Servicio de Oncología clínica, La Paz, Bolivia.
Autor CORRESPONSAL:
Rodolfo Fuertes Mamani, rodolfofuertes@neumobroncoscopia.edu
Resumen
Introducción: El Genexpert ultra como método de biología molecular aporta diagnóstico rápido y temprano en tuberculosis (TBC) al identificar resistencia a rifampicina. El cultivo tiene alta sensibilidad con crecimiento lento de las micobacterias y demora el diagnóstico temprano de TBC.
Objetivos: Demostrar el rendimiento diagnóstico del Genexpert ultra en lavado broncoalveolar (BAL) en pacientes con TBC pulmonar y comparar con el cultivo para TBC en BAL en el Hospital Luís Uría de la Oliva.
Material y métodos: Estudio prospectivo, realizado entre enero y diciembre del 2023. Se analizaron 43 muestras de pacientes con sospecha de enfermedad activa de TBC, se realizó BAL para detección de TBC por Genexpert MTB/RIF ultra y cultivo de BAL en medio sólido de Ogawa.
Resultados: De 43 pacientes que se sometieron a broncoscopia flexible, Genexpert ultra por BAL detectó TBC en 42 muestras (97,7%) y no detectó en 1 muestra (2,3%); en cultivo de BAL 32 muestras (74,4%) positivas y 11 (25,6%) negativas con una p:0,5. Comparando el Genexpert ultra de BAL con cultivo de BAL, se tiene una sensibilidad (S) de 97,6% con Valor Predictivo Positivo (VPP) de 100% de rendimiento diagnóstico para el Genexpert MTB/RIF ultra en BAL.
Conclusión: El Genexpert ultra en BAL tiene mejor rendimiento diagnóstico para TBC pulmonar en comparación con el cultivo en medio sólido de Ogawa en BAL, con S 97,6% VPP 100%, en comparación con el cultivo en BAL S 74,4%, VPP:100%.
Palabras claves: Genexpert, tuberculosis, lavado broncoalveolar, cultivo, rendimiento diagnóstico.
Abstract
Introduction: Genexpert ultra as a molecular biology method provides rapid and early diagnosis in tuberculosis (TB) by identifying resistance to rifampicin. The culture has high sensitivity with slow growth of mycobacteria delaying early diagnosis of TB.
Objectives: Demonstrate the diagnostic performance of Genexpert ultra in bronchoalveolar lavage (BAL) in patients with pulmonary TB and compare with the TB culture in BAL at the Luis Uría de la Oliva Hospital.
Material and methods: Prospective study, carried out between January and December 2023; 43 samples from patients with suspected active TB disease were analyzed, BAL was performed for TB detection by Genexpert MTB / RIF ultra and BAL culture in Ogawa solid medium.
Results: Of 43 patients who underwent flexible bronchoscopy, Genexpert ultra on BAL detected TB in 42 samples (97.7%) and did not detect TB in 1 sample (2.3%); in BAL culture, 32 samples (74.4%) were positive and 11 (25.6%) were negative with a p:0.5. Comparing Genexpert ultra on BAL with BAL culture, there is a sensitivity (S) of 97.6% with a Positive Predictive Value (PPV) of 100% of diagnostic performance for Genexpert MTB/RIF ultra on BAL.
Conclusion: Genexpert ultra on BAL has a better diagnostic performance for pulmonary TB compared to Ogawa solid medium culture on BAL, with S 97.6% PPV 100%, compared to BAL culture S 74.4%, PPV:100%.
Keywords: genexpert, tuberculosis, bronchoalveolar lavage, culture, diagnostic yield.
El Genexpert MTB/RIF ultra identifica el complejo Mycobacterium tuberculosis y detecta las mutaciones más frecuentes en el gen rpoβ asociadas a resistencia a rifampicina.1 Presenta alta sensibilidad en la detección de la tuberculosis (TBC) (88%). El valor predictivo negativo es superior al 98% tanto en lugares con una baja prevalencia de TBC como en aquellos con alta prevalencia de TBC.2 El Genexpert ha demostrado valor diagnóstico potencial para la detección rápida de la TBC pulmonar a partir de líquidos de lavado broncoalveolar (BAL) en los pacientes con escaso esputo y presunta tuberculosis pulmonar.3,4 El BAL es un procedimiento útil y seguro para tomar muestras de elementos celulares del pulmón, herramienta de diagnóstico que se utiliza para identificar con precisión diversas infecciones y también obtener material para cultivo y sensibilidad.5 Los autores Parsons L. et al. mencionan que la microscopía de frotis de esputo o baciloscopía de esputo varía entre 20 a 80% de rendimiento, a menudo depende del proceso de recolección de muestras, la tinción más utilizada es la descrita por Zhiel y Neelsen, que tiñe las micobacterias de rojo sobre fondo azul, en contraposición a las demás bacterias, que se tiñen de azul.6 Con relación a los cultivos, los medios líquidos como el sistema BACTEC MGIT 960 muestran mejor sensibilidad ya sea cuando se usan solos o en combinación con medio sólido como el de Löwenstein-Jensen.7 En Bolivia el método de cultivo sólido usado es de Ogawa, lo que dificulta su rendimiento al ser menos efectiva en relación con los medios líquidos.
Objetivos
El objetivo general es demostrar el rendimiento diagnóstico del Genexpert MTB/RIF ultra en BAL para tuberculosis pulmonar, en el hospital Luis Uría de la Oliva; los objetivos específicos son comparar las pruebas de Genexpert MTB/RIF ultra de BAL con el cultivo en medio sólido de BAL y mostrar la sensibilidad en el diagnóstico de la enfermedad por tuberculosis pulmonar.
Material y métodos
Diseño
El estudio es transversal, cuantitativo con recopilación de información de modo procedimental, se comparó el rendimiento del Genexpert MTB/RIF ultra en BAL con cultivo en medio sólido de Ogawa en BAL. Se utilizaron variables en un determinado momento realizando corte en tiempo y espacio.
La población estudiada fue de 43 pacientes internados con sintomatología activa de TBC, quienes se sometieron a broncoscopia flexible durante los meses enero a diciembre de la gestión 2023. El análisis de las 43 muestras de los pacientes se llevó a Genexpert y Cultivo para TBC, todos cumpliendo los criterios de inclusión. La muestra es no probabilística a conveniencia por tener unidades de análisis de pacientes que acuden al hospital en un periodo determinado con características clínicas de la enfermedad.
Criterios de inclusión
Pacientes mayores de 18 años internados por sintomatología de enfermedad activa de TBC pulmonar;8 Genexpert MTB/RIF ultra como método diagnóstico por video fibrobroncoscopía para BAL; cultivo en medio sólido de Ogawa del BAL;9 imágenes como radiografía o tomografía que muestren sospecha de enfermedad activa de TBC pulmonar;10 que acepten procedimiento de broncoscopia flexible para la realización de BAL.
Procedimiento
Ingresaron al estudio los pacientes internados con sintomatología de enfermedad activa, con radiografía o tomografía que demostrara alguna lesión sugerente de TBC pulmonar, pacientes que autorizaron la realización de broncoscopia flexible.
Se realizó procedimiento programado de video fibrobroncoscopía en quirófano de broncoscopia, con videobroncoscopio Olympus modelo BF160 de diámetro externo de 4,8mm y fibrobroncoscopio Olympus modelo BF-P30 de diámetro externo de 5,8mm, vía transnasal o bucal según tolerancia de paciente, bajo sedación por anestesiología. Se procedió a la toma de muestras de BAL entre 100 a 200 ml con solución salina al 0,9% en alícuotas de 20cc;11 se distribuyó la muestra en dos volúmenes iguales, se enviaron las muestras para Genexpert MTB/RIF ultra en tubos falcón con técnica de transporte en triple empaque;12 la muestra para Genexpert ultra fue procesada por el laboratorio del Centro Regional de salud de la ciudad del Alto. El análisis de todas las pruebas lo realizaron bioquímicos capacitados que desconocían la sintomatología clínica de los pacientes. Los reportes de los resultados del Genexpert MTB/RIF ultra de BAL fueron entregados de forma inmediata en el transcurso del mismo día.
La muestra para cultivo en medio sólido de Ogawa de BAL fue procesada inmediatamente en laboratorio de referencia de la Caja Nacional de Salud (CNS), los resultados finales de las lecturas del cultivo fueron pasados los 45 días, examinando semanalmente la búsqueda de colonias bacterianas visibles.
Recibió aval del Comité Bioética en investigación de la institución, donde todos los participantes firmaron consentimiento informado, cumpliendo los principios éticos de la investigación.
Análisis estadístico
Análisis descriptivo, analítico y cuantitativo, cuyas variables categóricas se presentan con porcentajes y frecuencias; las variables numéricas muestran las medias, medianas, desviación estándar y rangos según su distribución. El rendimiento diagnóstico de TBC pulmonar por Genexpert MTB/RIF ultra en BAL y cultivo en medio sólido de Ogawa en BAL se presenta con tablas cruzadas, evaluadas con la prueba Chi-cuadrado de Pearson, razón de verosimilitud, el error estándar con r de Pearson; la asociación se muestra con el índice de Kappa; con IC al 95% utilizando el programa SPSS Statistics versión 25. Se demuestra la S y VPP con el análisis de la curva de características operativas del receptor (ROC) para Genexpert ultra en BAL y cultivo para TBC en BAL.
Las variables con relación a la sintomatología de la enfermedad por TBC fueron tos, fiebre, sangrado pulmonar y pérdida de peso; las variables con relación al tiempo de presentación fueron de una semana, dos semanas, entre un mes y mayor a un mes expresadas con frecuencias y porcentajes.
Las variables con relación a imágenes (radiografía o tomografía) muestran las frecuencias y porcentajes de patrones imagenológicos como atelectasia en lóbulo medio, cavitación, consolidación con patrón nodular, consolidación, patrón nodular, cavitación con consolidación, cavitación con patrón nodular y árbol en brote (Figura 1).
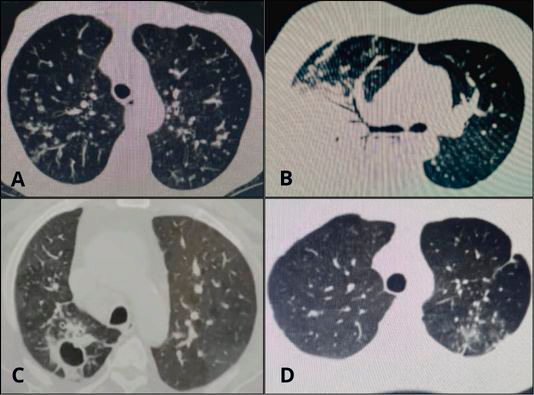
Figura 1.
Patrones tomográficos en presentación de tbc pulmonar.
Diferentes patrones de tomografía axial computarizada en ventana pulmonar: A= Patrón nodular, centrolobulillar con zonas de árbol en gemación bilateral a predominio de lóbulos superiores. B= Patrón de consolidación con zonas de nódulos a predominio de lóbulo medio. C= Patrón de cavitación con paredes gruesas en segmento III de lóbulo superior derecho. D= Patrón de árbol en brote en segmento III de lóbulo superior izquierdo con tendencia a la consolidación
Resultados
La población estudiada fue 43 pacientes, con diagnóstico de tuberculosis pulmonar activa. El 60,5% fueron varones y 39,5% mujeres, la edad media fue de 56,6 años, rango de 56 años (28-84). La sintomatología clínica de la enfermedad fue tos con 95,3% (41), pérdida de peso 65,1% (28), fiebre 60,5% (26) y sangrado pulmonar 27,9% (12). El tiempo de presentación de la enfermedad fue una semana 4,7% (2), dos semanas 25,6% (11), entre un mes 48,8% (21) y más de un mes 20,9% (9). Las características demográficas y sintomatología clínica de los participantes se presentan en la tabla 1.
Tabla 1.
Características demográficas y sintomatología clínica de los participantes
|
Variables |
Frecuencia |
Porcentaje válido |
|
|
Válido |
Masculino |
26 |
60,5% |
|
Femenino |
17 |
39,5% |
|
|
Total |
43 |
100% |
|
|
Edad en años de pacientes con TBC |
|||
|
Media de edad |
56,6 |
||
|
Error estándar de la media |
2,1 |
||
|
Mediana |
57 |
||
|
Rango |
56 |
||
|
Mínimo |
28 |
||
|
Máximo |
84 |
||
|
Sintomatología clínica de la TBC |
|||
|
Frecuencia |
Porcentaje |
||
|
Tos en TBC |
Si |
41 |
95,3% |
|
No |
2 |
4,7% |
|
|
Pérdida de Peso en TBC |
Si |
28 |
65,1% |
|
No |
15 |
34,9% |
|
|
Fiebre en TBC |
Si |
26 |
60,5% |
|
No |
17 |
39,5% |
|
|
Sangrado pulmonar en TBC |
Si |
12 |
27,9% |
|
No |
31 |
72,1% |
|
|
Tiempo de presentación de la enfermedad |
|||
|
Frecuencia |
Porcentaje |
||
|
Una semana |
2 |
4,7% |
|
|
Dos semanas |
11 |
25,6% |
|
|
Entre un mes |
21 |
48,8% |
|
|
Mayor a un mes |
9 |
20,9% |
|
Abreviatura: TBC= Tuberculosis
Fuente: Elaboración propia
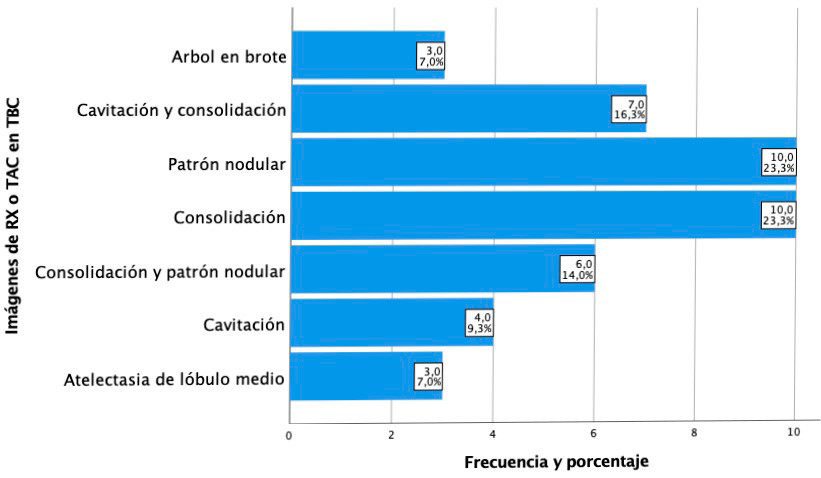
Con relación a los hallazgos imagenológicos, se mostraron los siguientes patrones; árbol en brote 7,0% (3), cavitación con consolidación 16,3% (7), patrón nodular 23,3% (10), consolidación 23,3% (10), consolidación con patrón nodular 14,0% (6), cavitación 9,3% (4) y atelectasia de lóbulo medio 7,0% (3). Las características de las frecuencias y porcentajes de los hallazgos imagenológicos se presentan en la figura 2.
Figura 2.
Imágenes de Rx o TAC en TBC pulmonar.
Abreviaturas: Rx= Radiografía, TAC= Tomografía axial computarizada, TBC= Tuberculosis. Variedad de patrones de imágenes que se encontraron en la enfermedad de TBC pulmonar. Fuente: Elaboración propia
Para el rendimiento diagnóstico de TBC pulmonar por cultivo en medio sólido de Ogawa en BAL, se analizaron un total de 43 muestras de pacientes detectando Mycobacterium tuberculosis el 74,4% (32) positivos y 25,6% (11) negativos, con una media 1,26 y error estándar de la media 0,06. Las frecuencias y porcentajes con relación al diagnóstico de TBC por cultivo en BAL se muestran en la tabla 2.
Tabla 2.
Diagnóstico de TBC pulmonar por muestras de cultivo en BAL
|
Frecuencia |
Porcentaje |
||
|
Válido |
Positivo |
32 |
74,4% |
|
Negativo |
11 |
25,6% |
|
|
Total |
43 |
100,0% |
|
|
Media |
1,26 |
||
|
Error estándar de la media |
0,06 |
||
Abreviatura: TBC= Tuberculosis, BAL= Lavado broncoalveolar.
Fuente: Elaboración propia.
Con relación al rendimiento diagnóstico del Genexpert MTB/RIF ultra por BAL, se demostró en 43 muestras de pacientes con Mycobacterium tuberculosis 97,7% (42) muestras detectadas y 2,3% (1) no detectada, con una media 1,07; error estándar de la media 0,07. Las frecuencias y porcentajes con relación a las muestras de Genexpert ultra en BAL se muestran en la tabla 3.
Tabla 3.
Diagnóstico de TBC pulmonar por muestras de Genexpert MTB/RIF ultra en BAL
|
Frecuencia |
Porcentaje |
||
|
Válido |
Detectado |
42 |
97,7% |
|
No detectado |
1 |
2,3% |
|
|
Total |
43 |
100,0% |
|
|
Media |
1,07 |
||
|
Error estándar de la media |
0,07 |
||
Abreviatura: TBC= Tuberculosis, BAL= Lavado broncoalveolar.
Fuente: Elaboración propia
Comparando el rendimiento diagnóstico de Genexpert MTB/RIF ultra en BAL con el cultivo para TBC en BAL, Genexpert MTB/RIF ultra detectó Mycobacterium tuberculosis en 97,7% (42) y cultivo para TBC 74,4% (32) positivos; no se detectó TBC en Genexpert MTB/RIF ultra 2,3% (1) y en cultivo de BAL 25,6% (11) negativos (Tabla 4). Estadísticamente, la comparación entre Genexpert MTB/RIF ultra en BAL y cultivo para TBC en BAL muestra el valor de p=0,55 con razón de verosimilitud 0,43 con IC al 95%, error estándar de r de Pearson p=0,04 y el índice de Kappa 0,56. (Tabla 5).
Tabla 4.
Tabla cruzada, comparación de Genexpert MTB/RIF ultra en BAL para TBC y cultivo de BAL para TBC
|
Positivo Negativo |
Cultivo de BAL para TBC |
Total |
|||
|
Positivo |
Negativo |
||||
|
Gene Xpert MTB/RIF ultra en BAL para TBC |
Detectado |
Recuento |
31 |
11 |
42 |
|
% del total |
72,1% |
25,6% |
97,7% |
||
|
No detectado |
Recuento |
1 |
0 |
1 |
|
|
% del total |
2,3% |
0% |
2,3% |
||
|
Total % del total |
Recuento |
32 |
11 |
43 |
|
|
74,4% |
25,6% |
100,0% |
|||
Abreviatura: BAL= Lavado broncoalveolar, TBC= Tuberculosis
Fuente: Elaboración propia.
Tabla 5.
Medidas simétricas estadísticas de la comparación entre Genexpert MTB/RIF ultra en BAL para TBC y Cultivo por BAL para TBC
|
Valor |
Error estándar asintóticoa |
Significación de Monte Carlo |
|||
|
Significación |
Intervalo de confianza al 95% |
||||
|
Límite inferior |
Límite superior |
||||
|
r de Pearson |
-0,09 |
0,04 |
0,56b |
0,980 |
1,000 |
|
Chi-cuadrado de Pearson |
0,35 |
Significación |
|||
|
0,55 |
|||||
|
Razón de verosimilitud |
0,59 |
0,43 |
|||
|
Índice de Kappa |
-0,22 |
0,56 |
|||
|
N ° de casos válidos 43 |
|||||
Abreviatura: BAL= Lavado broncoalveolar, TBC= Tuberculosis
a: No se presupone la hipótesis nula. b:Se basa en 43 tablas de muestras.
Fuente: Elaboración propia.
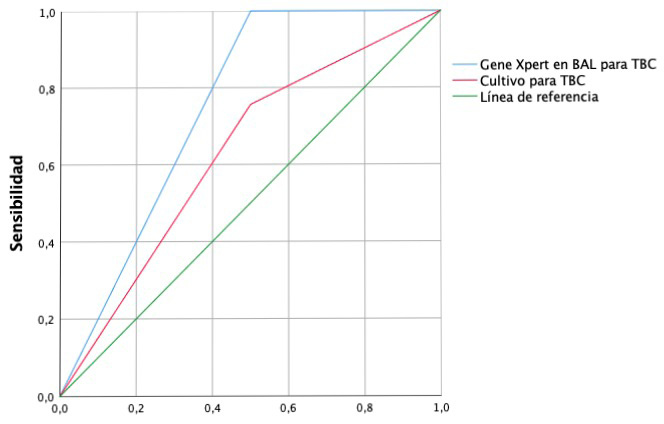
El Genexpert ultra en BAL mostró S 97,6% con VPP 100% en comparación con el cultivo para TBC en BAL que mostró S 74,4% con VPP 100%, lo que se puede observar en el análisis de la curva de ROC, donde la S fue mejor que el Genexpert ultra en BAL comparado con el cultivo de BAL. (Figura 3).
Figura 3.
Curva de ROC
Abreviaturas: ROC= Características Operativas del receptor, BAL= Lavado broncoalveolar, TBC= Tuberculosis. El análisis de la curva de ROC muestra áreas del Genexpert en BAL con mejor sensibilidad en comparación al análisis del cultivo en BAL. Fuente: elaboración propia.
Discusión
En nuestro estudio demostramos que el Genexpert ultra por BAL tiene mejor rendimiento en el diagnóstico de TBC. En las 43 muestras analizadas de pacientes con sospecha de la enfermedad activa, el Genexpert ultra demostró diagnóstico de TBC pulmonar en 97,7% (42), mientras que el cultivo para TBC en BAL demostró diagnóstico de 74,4% (32), con S discretamente superior para el Genexpert en comparación con el cultivo para TBC en BAL en medio sólido de Ogawa acidificado mediante el método Kudoh. Esta superioridad que encontramos en el Genexpert ultra puede corresponder a la técnica de realizar el cultivo en medio sólido de Ogawa, método manual que requiere descontaminación e inoculación del medio de cultivo y permite tomar muestras de bacterias, descontaminarlas y cultivarlas en un entorno controlado.13 Este cultivo de medio sólido necesita ser evaluado para mejorar su rendimiento en el aislamiento de micobacterias en comparación con los métodos en medios líquidos para cultivo en TBC.
El estudio tiene como muestra limitada a 43 pacientes con diagnóstico de tuberculosis en quienes se realizó Genexpert y Cultivo de BAL. No contamos con casos de control de población sana para identificar la especificidad ni el VPN, por lo que la fórmula en la tabla de contingencia 2x2 se limita a la S y VPP. 14
Podemos mencionar el estudio de Uddin M. et al. donde el ensayo Xpert tuvo una S significativamente mayor (92,9%, IC del 95%) en comparación con el cultivo y baciloscopía de esputo.3 Por otra parte, el estudio de Xu P. et al. menciona la importancia de las muestras por BAL al incrementar el valor diagnóstico de TBC pulmonar para pacientes con esputo negativo o de difícil expectoración.15 Una revisión sistemática y meta análisis de los autores Contreras D. et al. encontraron una sensibilidad y especificidad del 97% para el diagnóstico de TB pulmonar.16 Nuestro estudio coteja una S para Genexpert de 97,6% valor alto que permite mejor rendimiento diagnóstico. El estudio de Zhou Y. et al. hace referencia a la superioridad de Xpert MTB/RIF en BAL para el diagnóstico de TBC pulmonar comparando método de cultivo de micobacterias.17
Es interesante notar que la lidocaína como anestésico local tiene propiedades adicionales como actividad antimicrobiana contra Mycobacterium tuberculosis. En el caso de la broncoscopia, donde se aplica lidocaína tópica o en aerosol para anestesia local, estos efectos inhibidores podrían contribuir a una reducción del riesgo de transmisión de infecciones respiratorias. Kilaru S. et al. identificaron que el bajo rendimiento del cultivo en su estudio podría deberse al efecto micobactericida de la lidocaína utilizada durante el procedimiento de broncoscopia para obtener el BAL.18 Esta podría ser una razón para el rendimiento menor en nuestro estudio en el cultivo para TBC en BAL.
La OMS, desde 2010, respalda al Genexpert como método de diagnóstico rápido, oportuno para la TBC y, desde mayo 2013, con un grupo de expertos deciden incluir en la actualización de las políticas el uso de Xpert MTB/RIF, incluso para el diagnóstico de la TBC pediátrica como prueba diagnóstica inicial en todas las personas que se presume que tienen TBC pulmonar.2
Entre los signos y síntomas identificados acuerda con la evidencia científica mostrando la tos con expectoración y la pérdida de peso en mayor porcentaje.19,20 En nuestro estudio, la tos representa el 95,3% seguido de la pérdida de peso 65,1%. Sin embargo, debemos mencionar que puede existir un grupo pequeño de pacientes asintomáticos o poco sintomáticos que desarrollan la TBC activa. Por tal motivo, sugerimos, al presentar los síntomas constitucionales y pulmonares, tomar en cuenta la importancia de buscar la enfermedad activa de TBC con baciloscopias negativas mediante el Genexpert, en lugares de alta incidencia la TBC subclínica que podría contribuir considerablemente al aumento de la carga de tuberculosis, como lo menciona Stuck L. et al. quienes evidencian que los pacientes no siempre expresan síntomas de la enfermedad respiratoria.21
Finalmente aconsejamos a futuras investigaciones aumentar la muestra para estudios similares para poder corroborar la exactitud del rendimiento entre el Genexpert ultra en BAL y cultivo para TBC en BAL, y que esto permita considerar como gold estándar al Genexpert para su diagnóstico rápido y temprano, y evitar las complicaciones de las secuelas de tuberculosis o diagnósticos tardíos en cultivos o baciloscopías.
Conclusiones
Nuestros resultados demuestran que el Genexpert MTB/RIF ultra en BAL obtiene mejor rendimiento diagnóstico en comparación con el cultivo en medio sólido de Ogawa acidificado mediante el método Kudoh para tuberculosis pulmonar en BAL. El rendimiento mayor que demostramos con el Genexpert MTB/RIF ultra para TBC pulmonar nos permite llegar al diagnóstico de forma rápida, temprana y oportuna con una sensibilidad alta en comparación con el cultivo de medio sólido de Ogawa.
Agradecimientos: Jefatura de Microbiología de la CNS, del Hospital Luis Uría de la Oliva, Dr. Vladimir Feraudy.
Financiamiento: los autores declaran que el trabajo no tuvo financiamiento.
Conflictos de interés: los autores declaran que no tienen conflictos de intereses relacionados con el tema de esta publicación.
Contribuciones de los autores: RFM: conceptualización, escritura, revisión y edición; investigación; metodología; recursos; adquisición de fondos, redacción, borrador original; análisis formal. LNO: revisión y edición; investigación.
El Editor en Jefe, Dr. Carlos Luna, realizó el seguimiento del proceso de revisión y aprobó este artículo.
Referencias
1. Herrera T, Arias F, Ruiz N. Manual operativo Implementación del GeneXpert MTB/ RIF en el Programa de Tuberculosis. Ministerio de Salud, Gobierno de Chile 2017;7-8. [Internet]. [Consultado 1 sept 2024]. Disponible en: https://diprece.minsal.cl/wrdprss_minsal/wp-content/uploads/2018/02/2018.01.23_MANUAL-XPERT.pdf
2. World Health Organization. Xpert MTB/RIF implementation manual: technical and operational “how-to”: practical considerations. Vol. 1. Global TB Programme 2014;1–52. [Internet]. [Consultado 1 sept 2024]. Disponible en: https://apps.who.int/iris/bitstream/handle/10665/112469/9789241506700_eng.pdf
3. Uddin MK, Ather MF, Akter S et al. Diagnostic Yield of Xpert MTB/RIF Assay Using Bronchoalveolar Lavage Fluid in Detecting Mycobacterium tuberculosis among the Sputum-Scarce Suspected Pulmonary TB Patients. Diagnostics 2022;12,1676. Doi: 10.3390/diagnostics12071676
4. Maynard-Smith L, Larke N, Peters JA, Lawn SD. Diagnostic accuracy of the Xpert MTB/RIF assay for extrapulmonary and pulmonary tuberculosis when testing non-respiratory samples: a systematic review. BMC Infectious Diseases 2014;14:709. Doi: 10.1186/s12879-014-0709-7
5. Radha S, Afroz T, Prasad S, Ravindra N. Diagnostic utility of bronchoalveolar lavage. J Cytol 2014;31(3):136–138. Doi: 10.4103/0970-9371.145636
6. Parsons LM, Somoskövi Á, Gutierrez C et al. Laboratory diagnosis of tuberculosis in resource-poor Countries: Challenges and opportunities. Clin Microbiol Rev 2011;24:314–350. Doi: 10.1128/CMR.00059-10
7. Alcaide F, Angel Benítez M, Escriba JM, Martiín R. Evaluation of the BACTEC MGIT 960 and the MB/BacT Systems for Recovery of Mycobacteria from Clinical Specimens and for Species Identification by DNA AccuProbe. J Clin Microbiol 2000;38:398–401. Doi: 10.1128/JCM.38.1.398-401.2000
8. Tateosian NL, Morelli MP, Pellegrini JM, García VE. Beyond the Clinic: The Activation of Diverse Cellular and Humoral Factors Shapes the Immunological Status of Patients with Active Tuberculosis. Int J Mol Sci 2023;24:5033. Doi: 10.3390/ijms24055033
9. Programa Nacional de control de Tuberculosis y lepra. Manual de Normas técnicas en Tuberculosis. Ministerio de Salud, estado plurinacional de Bolivia 2017; 25–26. [Internet]. [Consultado 1 sept 2024]. Disponible en: https://www.minsalud.gob.bo/images/Libros/Tuberculosis/Manual_de_Normas_TB_2017.pdf
10. Ravenel JG, Chung JH, Ackman JB et al. ACR Appropriateness Criteria® Imaging of Possible Tuberculosis. J Am Coll Radiol 2017;14:160–165. Doi: 10.1016/j.jacr.2017.02.022
11. Siddiqui SS, Sharma T, Khurana AK et al. Bronchoalveolar lavage in diagnostic evaluation of pulmonary diseases- An institutional experience. J Cytol 2023;40(2):68-74. Doi: 10.4103/joc.joc_90_22
12. Sánchez JH, Gouveia S, Cameselle C. Transport of High-Risk Infectious Substances: Packaging for the Transport of Category A Infectious Specimens in Spain. Int J Environ Res Public Health 2022;19(20). Doi: 10.3390/ijerph192012989
13. Zaporojan N, Negrean RA, Hodișan R, Zaporojan C, Csep A, Zaha DC. Evolution of Laboratory Diagnosis of Tuberculosis. Clin Pract 2024;23:14(2):388–416. Doi: 10.3390/clinpract14020030
14. Vizcaíno G. Importancia del cálculo de la sensibilidad, la especificidad y otros parámetros estadísticos en el uso de las pruebas de diagnóstico clínico y de laboratorio. Artículos de reflexión. Medicina y Laboratorio 2017;23:7-8.
15. Xu P, Tang P, Song H et al. The incremental value of bronchoalveolar lavage for the diagnosis of pulmonary tuberculosis in a high-burden urban setting. J Infect 2019;79(1):24–9. Doi: 10.1016/j.jinf.2019.05.009
16. Contreras D, Sánchez MA. Sensibilidad y especificidad de la técnica GeneXpert MTB/RIF para el diagnóstico de tuberculosis: Una revisión sistemática y meta-análisis. Casos y Revisiones de Salud 2024;6(1):87–119. Doi: 10.22201/fesz.26831422e.2024.6.1.7
17. Zhou YY, Shi JC, Pan N et al. The value of GeneXpert MTB/RIF in bronchoalveolar lavage fluid in the diagnosis of smear-negative pulmonary tuberculosis. Invest Clin 2021;62(1):28–36. Doi: 10.22209/IC.v62n1a03
18. Kilaru SC, Chenimilla NP, Syed U et al. Role of Xpert MTB/RIF in Bronchoalveolar lavage fluid of sputum-scarce, suspected Pulmonary TB patients. J Clin Tuberc Other Mycobact Dis 2019;14:7–11. Doi: 10.1016/j.jctube.2018.11.003
19. Lyon SM, Rossman MD. Pulmonary Tuberculosis. Microbiology Spectrum 2017;5. Doi: 10.1128/microbiolspec.TNMI7-0032-2016
20. Loddenkemper R, Lipman M, Zumla A. Clinical Aspects of Adult Tuberculosis. Cold Spring Harb Perspect Med 2016;6(1). Doi: 10.1101/cshperspect.a017848
21. Stuck L, Klinkenberg E, Abdelgadir A et al. Prevalence of subclinical pulmonary tuberculosis in adults in community settings: an individual participant data meta-analysis. Lancet Infect Dis 2024;24(7):726–36. Doi: 10.1016/S1473-3099(24)00011-2