

REVISIÓN | Respirar, 2025; 17(2): 179-187 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.17.2.9
Olivia Sánchez Cabral
https://orcid.org/0009-0003-6767-2506
Carlos Camarena Cisneros
https://orcid.org/0000-0001-8874-7835
Juan Gerardo Alcaraz López
https://orcid.org/0000-0002-3865-1197
Ezequiel Morinigo
https://orcid.org/0009-0009-0897-492X
Walter Mosqueda Hernández
https://orcid.org/0009-0004-7037-4670
Recibido:
13 agosto 2024
Aprobado:
16 diciembre 2024
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
Lavado pulmonar total: una revisión exhaustiva de técnicas, eficacia y desenlaces
Whole Lung Lavage: a Comprehensive Review of Techniques, Efficacy and Outcomes
Olivia Sánchez Cabral1 , Carlos Camarena Cisneros2
, Carlos Camarena Cisneros2 , Juan Gerardo Alcaraz López2
, Juan Gerardo Alcaraz López2 , Ezequiel Morinigo2
, Ezequiel Morinigo2 , Walter Mosqueda Hernández2
, Walter Mosqueda Hernández2
1. Instituto Nacional de Enfermedades Respiratorias, Ciudad de México, México
2. Hospital de Especialidades del Centro Médico Nacional de Occidente, Guadalajara, México
Autor CORRESPONSAL:
Juan Gerardo Alcaraz López, alcarazjuang@gmail.com
Resumen
El lavado pulmonar total (LPT) constituye una intervención consolidada para el manejo de la proteinosis alveolar pulmonar. A pesar de su implementación desde hace décadas, persisten interrogantes en torno a sus indicaciones, variaciones técnicas y desenlaces clínicos. Esta revisión exhaustiva tiene como propósito proporcionar un análisis riguroso y actualizado sobre el estado del arte del LPT.
Abordamos su evolución histórica y profundizamos en los matices de la selección de pacientes, la evaluación preoperatoria y la optimización del manejo perioperatorio. Analizamos minuciosamente la ejecución del procedimiento, proponiendo una estrategia refinada para la infusión y recuperación de la solución salina, además de ofrecer recomendaciones técnicas que optimicen su aplicación. Asimismo, exploramos enfoques innovadores de lavado pulmonar, evaluando sus beneficios, limitaciones e implicaciones clínicas.
Por último, discutimos su eficacia terapéutica; resaltamos la imperiosa necesidad de establecer métricas estandarizadas de resultados y generar evidencia longitudinal sobre su impacto a largo plazo. Confiamos en que la estrategia propuesta y las directrices técnicas aquí expuestas contribuyan a la estandarización del procedimiento, fomentando el diálogo entre expertos a nivel internacional y estimulando nuevas líneas de investigación orientadas a perfeccionar la técnica y ampliar su aplicabilidad clínica.
Palabras clave: lavado pulmonar total, proteinosis alveolar, broncoscopia, tubo endotraquel de doble lumen.
Abstract
Whole lung lavage (WLL) is a well-established therapeutic procedure for the management of pulmonary alveolar proteinosis. Despite its long-standing use, questions remain regarding its indications, techniques and outcomes. This comprehensive review aims to provide a detailed analysis of the current state of knowledge on WLL.
We explore the history and delve into the intricacies of patient selection, pre-procedural assessment and perioperative management. We examine the procedural details in-depth, describe a technique regarding the infusion and retrieval of saline solution, and provide technical recommendations for the entire procedure. Moreover, we will discuss other novel WLL techniques and their respective advantages, limitations, and complications.
Finally, we will address therapeutic efficacy, highlighting the need for standardized outcome measures and long-term follow-up data. We hope that the proposed technique and technical advice discussed brings us one step forward regarding the standardization of the procedure by exhorting international expert panel discussions and that the ideas mentioned stimulate further investigation into WLL utility and enhancement.
Keywords: whole lung lavage, alveolar proteinosis, bronchoscopy, double-lumen endotracheal tube.
Introducción
El lavado pulmonar total (LPT) es una intervención broncopulmonar consolidada, utilizada durante más de medio siglo para el manejo de la proteinosis alveolar pulmonar (PAP).
El procedimiento consiste en la instilación de volúmenes sustanciales de solución salina templada en un pulmón bajo anestesia general, seguida de su drenaje estratégico con el propósito de eliminar las acumulaciones lipoproteicas en los espacios aéreos. Desde su primera descripción en la década de 1960, el LPT ha sido objeto de refinamientos técnicos que han optimizado su perfil de seguridad y eficacia. No obstante, persisten interrogantes en torno a la técnica idónea, el momento oportuno para su implementación y sus repercusiones a largo plazo.
A pesar de su extensa trayectoria, el LPT continúa suscitando un interés sostenido entre clínicos e investigadores, impulsado por la evolución de sus indicaciones, los avances en su ejecución y la consolidación de nuevas evidencias sobre su eficacia y seguridad. A medida que la experiencia clínica se ha ampliado, también lo ha hecho nuestra comprensión sobre las complejidades de la selección de pacientes, la temporalidad óptima del procedimiento y las posibles complicaciones asociadas.
En la actualidad, la proteinosis alveolar es una entidad cuya detección es posible mediante pruebas no invasivas como la serología para anticuerpos contra el factor estimulador de colonias de granulocitos-macrófagos, lo que probablemente incrementará la tasa de diagnóstico de la enfermedad.
El LPT constituye el tratamiento de primera línea ampliamente aceptado para el manejo de la insuficiencia respiratoria en estos pacientes y, previsiblemente, seguirá desempeñando un papel fundamental en su abordaje terapéutico.
Los avances recientes en tecnología broncoscópica y anestesia han propiciado una evolución significativa en las técnicas de LPT, lo que ha optimizado la seguridad y eficacia del procedimiento. No obstante, la ausencia de protocolos estandarizados y la heterogeneidad de las manifestaciones clínicas subrayan la necesidad de un análisis exhaustivo de los aspectos técnicos y las indicaciones del procedimiento.
Historia del lavado pulmonar total (LPT)
En 1963, Ramírez-Rivera et al. introdujeron la técnica de «inundación segmentaria», que consistía en la instilación de 100 mL de solución salina isotónica con acetilcisteína o heparina, administrada cuatro veces al día a través de un tubo endotraqueal de Carlens de doble luz. El procedimiento se realizaba de manera alternante en cada pulmón durante un período de dos a tres semanas en una serie de dos pacientes, quienes experimentaron una mejoría clínica significativa.1
En 1964, los mismos autores publicaron una versión optimizada de la técnica, elevando la bolsa de solución salina a 30 cm por encima del tórax para generar una presión hidrostática que superara la presión arterial pulmonar media, y mitigara así el riesgo de hipoxemia, además de incorporar anestesia general.2
El primer reporte de lavado pulmonar total bilateral se documentó en 1969, en el caso de dos hermanos afectados por proteinosis alveolar pulmonar, en quienes se empleó inicialmente un abordaje parcial del procedimiento.3
Posteriormente, en 1977, Selecky et al. publicaron su experiencia acumulada a lo largo de una década; presentaron mejoras técnicas sustanciales, como la expansión del volumen de líquido instilado hasta 18 litros y la optimización del intervalo entre el drenaje y la reposición del fluido, lo que permitió incrementar la eficiencia del procedimiento.4
Indicaciones y uso oportuno del LPT
El LPT es ampliamente aceptado como tratamiento de soporte de elección para PAP y algunos casos de PAP secundaria.5,6
Otras indicaciones
El lavado pulmonar total se encuentra ampliamente indicado y reservado para pacientes con proteinosis alveolar pulmonar; no obstante, su aplicación ha sido descrita con tasas de éxito variables en el manejo de la microlitiasis alveolar pulmonar7-9 y la silicosis.10-12
Adicionalmente, el lavado pulmonar terapéutico dirigido ha sido reportado en el tratamiento de diversas afecciones pulmonares infrecuentes, como la neumonía lipoidea exógena13 e, interesantemente, en el asma.14 En estos escenarios, la técnica se implementa en uno o múltiples segmentos pulmonares con el propósito de eliminar material acumulado o toxinas en los alvéolos, lo que contribuye a la atenuación de los síntomas respiratorios y a la optimización de la función pulmonar.
Sin embargo, la evidencia que respalda el uso del LPT en estas patologías sigue siendo limitada, lo que subraya la necesidad de investigaciones adicionales que clarifiquen su papel terapéutico y establezcan su eficacia dentro del abordaje clínico.
Selección y evaluación de pacientes candidatos
En la PAP, el LPT se realiza cuando empeoran síntomas como la disnea y/o la tos. Esto junto con un aumento de las opacidades radiográficas difusas en las imágenes, una disminución de la presión arterial de oxígeno en reposo (PaO2) y/o una disminución del factor de transferencia (capacidad de difusión) para el monóxido de carbono (DLCO).15
Contraindicaciones y riesgos
Las contraindicaciones para la realización de la LPT comprenden la inestabilidad respiratoria o cardiovascular severa, la presencia de una coagulopatía no corregida, la neumonía activa de etiología infecciosa—dado el riesgo incrementado de sepsis—y ciertas anomalías estructurales pulmonares o de la pared torácica que puedan dificultar el aislamiento pulmonar o comprometer la seguridad del procedimiento.16
Los riesgos inherentes al lavado pulmonar total deben ser meticulosamente ponderados frente a los beneficios potenciales en cada caso clínico. Entre las complicaciones descritas se incluyen hipoxemia, inestabilidad hemodinámica, infecciones, barotrauma y eventos adversos vinculados a la anestesia, los cuales requieren una vigilancia estrecha y una gestión perioperatoria rigurosa.
Técnicas para el LPT
LPT unipulmonar
La técnica de lavado unipulmonar es la preferida por la mayoría de las instituciones ya que se considera más segura e implica el lavado secuencial de cada pulmón en sesiones separadas, normalmente espaciadas varios días o semanas. Consideramos adecuado un tiempo mínimo de tres semanas entre procedimientos, sin embargo, debe aplicarse un enfoque individualizado, teniendo en cuenta la carga sintomática, las características de imagen y los estudios fisiológicos.
Lavado bipulmonar secuencial
El lavado bilateral secuencial es una variación de la técnica de lavado unipulmonar en la que se lavan ambos pulmones durante la misma sesión anestésica, lavando primero un pulmón y después el otro. Este enfoque puede reducir el número de exposiciones anestésicas y minimizar el tiempo de hospitalización, con la consiguiente reducción de costes. Sin embargo, requiere un tiempo quirúrgico considerablemente más largo y plantea un mayor riesgo de hipoxemia e inestabilidad hemodinámica en comparación con el lavado unipulmonar, por lo que la selección cuidadosa de los pacientes y la monitorización son fundamentales para su aplicación segura.
Evaluación pre-procedimiento
Antes del LPT debe realizarse una evaluación exhaustiva para valorar el estado de salud general del paciente, identificar cualquier contraindicación y determinar los riesgos y beneficios potenciales del procedimiento. Esta evaluación incluye una historia clínica completa, un examen físico y pruebas de laboratorio, así como pruebas de función pulmonar, análisis de gases en sangre arterial e imágenes torácicas.
Procedimiento
Composición, volumen y temperatura del líquido del lavado pulmonar
La solución salina estéril a temperatura corporal se emplea habitualmente como medio de lavado, manteniéndose preferentemente a 37°C, con un monitoreo continuo de la temperatura central y la temperatura cutánea media.
El procedimiento se inicia con la instilación de un volumen equivalente a aproximadamente la mitad de la capacidad residual funcional (CRF) previamente determinada. Mantener esta cantidad de líquido en el parénquima pulmonar facilita la irrigación sin comprometer la expansión alveolar.
A partir de este punto, se procede con la fase de lavado mediante la instilación y aspiración intermitente de aproximadamente 80 mL de solución, utilizando un par de jeringas de irrigación de bulbo con una capacidad óptima de 100 mL. La presión generada por estas jeringas, junto con su capacidad de aspiración eficiente, permite la ejecución del procedimiento de manera fluida y controlada.
Al concluir el procedimiento, se prioriza la recuperación exhaustiva del líquido instilado mediante la aplicación de succión gentil con un broncoscopio. En nuestros centros, habitualmente se realiza el lavado con aproximadamente 20 litros; sin embargo, este volumen varía significativamente en función de la gravedad del compromiso pulmonar y de factores individuales que inciden en la tolerancia del procedimiento.
Es imperativo llevar un registro preciso del volumen de líquido recuperado, con el objetivo de alcanzar una tasa de recuperación superior al 60-70%. Para ello, recomendamos la utilización de una hoja de registro detallada que documente tanto el volumen instilado como el recuperado.23
Hemos observado que esta estrategia optimizada permite reducir la duración del procedimiento y, potencialmente, incrementar la cantidad de material proteináceo eliminado en comparación con la técnica clásica.
La técnica de infusión continua, considerada el método tradicional, se lleva a cabo con el paciente en decúbito lateral y un ángulo de Trendelenburg de 45°, posicionando el lado tratado hacia arriba.24 En esta configuración, el pulmón dependiente se mantiene conectado al ventilador, mientras que el pulmón sometido al lavado se acopla a un sistema de tres vías. Un extremo del sistema se enlaza con una bolsa de 1.000 mL de solución salina al 0,9%, situada a 50 cm de altura y conectada a un calentador de fluidos, mientras que el otro extremo se une a un tubo de aspiración de 50 cm dirigido a un recipiente colector.23
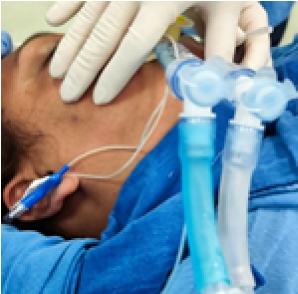
Inicialmente, el tubo de aspiración se mantiene pinzado. Una vez asegurado el aislamiento pulmonar y confirmada una saturación de oxígeno (SpO₂) cercana al 100%, se libera la oclusión y la solución calentada se administra por gravedad a través de un tubo endotraqueal de doble luz hasta el pulmón objetivo. (Figura 1).
Figura 1.
Tubo endotraqueal de doble lumen inmediatamente después de la intubación y antes de la colocación en posición lateral izquierda
El ciclo de lavado puede implicar la instilación de un volumen de 500 a 1.000 cc, dependiendo de la complexión del paciente, o bien prolongarse hasta alcanzar la capacidad máxima del pulmón, determinada por la observación de la columna líquida en el tubo endotraqueal. Una vez logrado este umbral, se libera la oclusión y el líquido es drenado hacia el contenedor correspondiente.25
Cuando el flujo de drenaje cesa, se reabre el circuito de infusión y se inicia un nuevo ciclo de lavado. La duración de cada ciclo oscila entre 3 y 5 minutos. (Figura 2). Se ha descrito el uso de sistemas de infusión rápida con el propósito de reducir la duración del procedimiento; sin embargo, es imperativo mantener una monitorización estricta de la presión para mitigar el riesgo de barotrauma.26
Figura 2.
Jeringas de bulbo aspirando fluido y percusión manual
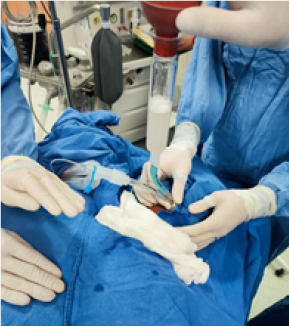
La percusión torácica se emplea como una estrategia coadyuvante para optimizar la eliminación del material proteináceo, aplicándose en cada ciclo durante un lapso de tres a cinco minutos, tanto tras la instilación del volumen máximo como durante la fase de drenaje.
La finalización del procedimiento se define por la evaluación macroscópica del líquido recolectado o mediante la medición de la densidad óptica (DO) a una longitud de onda de 405 nm, con un umbral <0,4.21 Una vez alcanzado este criterio, se lleva a cabo un intento final de aspiración residual del líquido remanente. Posteriormente, el tubo endotraqueal de doble luz es reemplazado por un tubo endotraqueal de luz única mientras el paciente emerge progresivamente de la anestesia.
La duración total del procedimiento varía entre 2 y 6 horas, dependiendo de la severidad del compromiso pulmonar.
La mayoría de los pacientes son desvinculados de la ventilación mecánica en un período breve; sin embargo, este tiempo es variable y se encuentra condicionado principalmente por el estado respiratorio preprocedimiento y por la eficiencia en la recuperación del líquido instilado.
Cabe destacar que, en pacientes de alto riesgo con insuficiencia respiratoria, el procedimiento puede realizarse con soporte vital extracorpóreo (SVEC).27-29
Monitorización durante LPT
La monitorización ininterrumpida de la hemodinamia, la oxigenación, la ventilación y la homeotermia del paciente constituye un pilar fundamental durante la realización del LPT. Es imperativo alcanzar un equilibrio óptimo entre la eliminación eficiente del material alveolar y la mitigación del riesgo de sobrecarga hídrica o deterioro hemodinámico.
Las posibles complicaciones, como la hipoxemia, la inestabilidad cardiovascular o el barotrauma, requieren una intervención inmediata mediante el ajuste del volumen de instilación, la modulación de la frecuencia del procedimiento o la optimización de la estrategia ventilatoria. En determinadas circunstancias, si el estado clínico del paciente se ve comprometido, puede ser necesario interrumpir temporalmente o finalizar el procedimiento para preservar su seguridad.
El monitoreo riguroso del balance hídrico, mediante la colocación de una sonda urinaria para la medición de la diuresis, resulta esencial para la evaluación dinámica del estado volémico. Asimismo, se recomienda la realización de una gasometría arterial basal y controles seriados según la evolución clínica.
Una coordinación estrecha entre el neumólogo intervencionista, el anestesiólogo y el resto del equipo multidisciplinario es crucial para optimizar la seguridad del procedimiento y maximizar los resultados terapéuticos.
Tras la intervención, y previo al traslado del paciente a su unidad de recuperación, debe efectuarse una radiografía de tórax con el propósito de evaluar la resolución del proceso patológico y descartar eventuales complicaciones postoperatorias.
Eficacia terapéutica y desenlaces
El lavado pulmonar total ha demostrado ser sumamente eficaz en el tratamiento de la PAP, y la mayoría de los pacientes experimentan mejoras notables en los síntomas respiratorios, la oxigenación y la función pulmonar.4, 5, 16 La duración del beneficio terapéutico varía, algunos pacientes permanecen asintomáticos durante años, mientras que otros pueden requerir la repetición del LVP. Los resultados a largo plazo suelen ser favorables, y el procedimiento se ha asociado con una reducción de la morbilidad y una mejora de la calidad de vida en pacientes con PAP.30, 31
Complicaciones
De acuerdo con Campo et al.,11 las complicaciones más prevalentes son fiebre (18%), hipoxemia (14%), sibilancias (6%), neumonía (5%) y fuga de fluidos (4%). Cabe destacar que ningún paciente requirió ventilación mecánica prolongada. Tal como se ha mencionado anteriormente, la hipoxemia suele ser transitoria y la mayoría de los pacientes experimenta una mejora significativa de la saturación de oxígeno entre 6 y 12 horas después. El procedimiento se considera seguro, aunque otras complicaciones pueden incluir hidroneumotórax, neumonía, síndrome de dificultad respiratoria aguda y sepsis.
Terapias nuevas y adyuvantes
Factor estimulante de colonias de macrófagos granulocitos recombinante (rGM-CSF)
Un estudio fundamental investigó la eficacia terapéutica del GM-CSF humano recombinante inhalado (sargramostim) en pacientes con proteinosis alveolar pulmonar autoinmune. En un ensayo doble ciego controlado con placebo en el que participaron 64 pacientes, se observó una mejora significativa del gradiente alveolar-arterial de oxígeno en el grupo tratado con GM-CSF en comparación con el grupo placebo. El estudio también informó de cambios en la densidad del parénquima pulmonar en la tomografía computarizada, pero no observó beneficios clínicos significativos. Hubo algunos eventos adversos graves en ambos grupos, 6 en el grupo de tratamiento y 3 en el grupo de control, aunque fueron muy variados.32
En otro estudio que incluyó a 18 pacientes con PAP de moderada a grave, los participantes se sometieron a un LPT inicial y luego se dividieron en dos grupos: uno que recibió sargramostim inhalado (grupo rGM-CSF) y un grupo de control sin tratamiento programado. Durante un periodo de 30 meses tras el LPT inicial, los pacientes del grupo rGM-CSF mostraron una mayor duración antes de requerir un LPT adicional (30 meses) en comparación con el grupo de control (18 meses). Además, se observó una diferencia significativa en la necesidad de LPT adicional, ya que el 78% de los pacientes del grupo de control lo requirieron, frente al 11% de los pacientes tratados con rGM-CSF. El grupo tratado con rGM-CSF también mostró una mayor mejora en los biomarcadores de oxigenación y PAP. No se notificaron eventos adversos graves.33
Seguimiento
Llevamos a cabo una evaluación a corto plazo mediante radiografía de tórax y pruebas fisiológicas (DLCO) a cada paciente dos semanas después de la presentación inicial. Posteriormente, se programa otra visita entre 3 y 6 meses, dependiendo del estado del paciente. (Figura 3).
Figura 3.
TC a nivel subcarinal antes (izquierda) y después (derecha) del lavado pulmonar completo. Observe mejoras modestas después de 1 mes de seguimiento

La mediana del tiempo hasta la recaída se ha reportado en aproximadamente 15 meses; no obstante, en nuestras instituciones tomamos la decisión, junto con el paciente, de realizar el procedimiento antes de este periodo, en la mayoría de los casos alrededor de 8 meses.
Conclusión
El lavado pulmonar total desempeña un rol primordial en el manejo de la proteinosis alveolar pulmonar. Debido a su seguridad y eficacia, es ampliamente reconocido como el tratamiento estándar. Un conocimiento profundo de las indicaciones, contraindicaciones, la técnica del procedimiento y las posibles complicaciones es esencial para asegurar resultados óptimos para el paciente. Proporcionamos una descripción técnica exhaustiva del procedimiento y delineamos una técnica que implica la infusión intermitente y la recuperación de líquido mediante jeringas de pera. Consideramos que la modificación de la técnica podría optimizar el tiempo de intervención y la calidad del efluente, aunque esto requiere estudios clínicos adicionales.
Con el desarrollo de tratamientos innovadores, principalmente GM-CSF, se redefinirá el papel del lavado pulmonar total. No obstante, su relevancia en la mejora inmediata de la carga sintomática y la función pulmonar seguirá siendo sustancial.
Financiamiento: los autores declaran que el trabajo no tuvo financiamiento.
Conflictos de interés: los autores declaran que no tienen conflictos de intereses relacionados con el tema de esta publicación.
Contribuciones de los autores: OSC: revisión de la literatura, análisis de datos y redacción de la sección de detalles técnicos. CCC: redacción del manuscritos, revisión de datos de seguimiento y desenlaces, información clínica. JGAL: conceptualización, redacción del manuscrito, revisión de la literatura y aprobación final del manuscrito. EM: supervisión de proyecto, contribución de opiniones de expertos sobre técnicas de intervención, y revisión final del manuscrito. WMH: confección de figuras y revisión del manuscrito.
Los Editores en Jefe, Dr. Carlos Luna y Dr. Francisco Arancibia, realizaron el seguimiento del proceso de revisión y aprobaron este artículo.
Referencias
1. Ramirez RJ. Pulmonary Alveolar Proteinosis: A New Technique and Rationale for Treatment. Arch Intern Med 1963;112(3):419. Doi: 10.1001/archinte.1963.03860030173021
2. Ramirez RJ. Bronchopulmonary Lavage in Man. Ann Intern Med 1965;63(5):819. Doi: 10.7326/0003-4819-63-5-819
3. Seard C, Wasserman K, Benfield J, Cleveland R, Costley D, Heimlich E. Simultaneous Bilateral Lung Lavage (Alveolar Washing) Using Partial Cardiopulmonary Bypass Report of Two Cases in Siblings. Am Rev Respir Dis 1969;101(6). Doi: 10.1164/arrd.1970.101.6.877
4. Selecky PA, Wasserman K, Benfield JR, Lippmann M. The Clinical and Physiological Effect of Whole-Lung Lavage in Pulmonary Alveolar Proteinosis: A Ten-Year Experience. Ann Thorac Surg 1977;24(5):451–61. Doi: 10.1016/s0003-4975(10)63440-6
5. Gay P, Wallaert B, Nowak S et al. Efficacy of Whole-Lung Lavage in Pulmonary Alveolar Proteinosis: A Multicenter International Study of GELF. Respiration 2017;93(3):198–206. Doi: 10.1159/000455179
6. Trapnell BC, Nakata K, Bonella F et al. Pulmonary alveolar proteinosis. Nat Rev Dis Primer 2019;5(1):16. Doi: 10.1038/s41572-019-0066-3
7. Mascie-Taylor BH, Wardman AG, Madden CA, Page RL. A case of alveolar microlithiasis: observation over 22 years and recovery of material by lavage. Thorax 1985;40(12):952–3. Doi: 10.1136/thx.40.12.952
8. Palombini BC, Silva Porto ND, Wallau CU, Camargo JJ. Bronchopulmonary Lavage in Alveolar Microlithiasis. Chest 1981;80(2):242–3. Doi: 10.1378/chest.80.2.242
9. Caputi M, Guarino C, Cautiero V, Castellano G, Perna A. Diagnostic role of BAL in pulmonary alveolar microlithiasis. Arch Monaldi Mal Torace 1990;45(5):353–64.
10. Mason G, Abraham J, Hoffman L, Cole S, Lippmann M, Wasserman K. Treatment of Mixed-Dust Pneumoconiosis with Whole Lung Lavage. Am Rev Respir Dis 1982;126(6).
11. Prudon B, Attanoos R, Morgan C, Stenton S. P112 Therapeutic Whole Lung Lavage For Silicosis – First Application in the UK. Thorax 2012;67(Suppl 2):A111.1-A111. Doi: 10.1136/thoraxjnl-2012-202678.395
12. Wilt JL, Banks DE, Weissman DN et al. Reduction of Lung Dust Burden in Pneumoconiosis by Whole-Lung Lavage: J Occup Environ Med 1996;38(6):619–24. Doi: 10.1097/00043764-199606000-00014
13. Shang L, Gu X, Du S et al. The efficacy and safety of therapeutic lung lavage for exogenous lipoid pneumonia: A systematic review. Clin Respir J 2021;15(2):134–46. Doi: 10.1111/crj.13273
14. König G. Therapie des lebensbedrohenden Status asthmaticus auf der Intensivstation. Atemw Lungenkrklr 1985;(11):518–22.
15. Seymour JF, Presneill JJ. Pulmonary Alveolar Proteinosis: Progress in the First 44 Years. Am J Respir Crit Care Med 2002;166(2):215–35. Doi: 10.1164/rccm.2109105
16. Campo I, Luisetti M, Griese M et al; for the WLL International Study Group. Whole lung lavage therapy for pulmonary alveolar proteinosis: a global survey of current practices and procedures. Orphanet J Rare Dis 2016;11(1):115. Doi: 10.1186/s13023-016-0497-9
17. Diaz-Mendoza J, Celis Valdiviezo E, Patel NM, Simoff MJ. One-session bilateral sequential whole lung lavage (OSBSWLL) for the management of pulmonary alveolar proteinosis. BMC Pulm Med 2021;21(1):358. Doi: 10.1186/s12890-021-01734-w
18. Stengel PW, Frazer DG, Weber KC. Lung degassing: an evaluation of two methods. J Appl Physiol 1980;48(2):370–5. Doi: 10.1152/jappl.1980.48.2.370
19. Gao S, Zhang Z, Brunelli A et al. The Society for Translational Medicine: clinical practice guidelines for mechanical ventilation management for patients undergoing lobectomy. J Thorac Dis 2017;9(9):3246–54.
20. Hammon WE, McCaffree DR, Cucchiara AJ. A Comparison of Manual to Mechanical Chest Percussion for Clearance of Alveolar Material in Patients With Pulmonary Alveolar Proteinosis (Phospholipidosis). Chest 1993;103(5):1409–12. Doi: 10.1378/chest.103.5.1409
21. Grutters LA, Smith EC, Casteleijn CW et al. Increased Efficacy of Whole Lung Lavage Treatment in Alveolar Proteinosis Using a New Modified Lavage Technique. J Bronchol Interv Pulmonol 2021;28(3):215–20. Doi: 10.1097/LBR.0000000000000741
22. Bonella F, Bauer PC, Griese M, Wessendorf TE, Guzman J, Costabel U. Wash-out kinetics and efficacy of a modified lavage technique for alveolar proteinosis. Eur Respir J 2012;40(6):1468–74. Doi: 10.1183/09031936.00017612
23. Awab A, Khan MS, Youness HA. Whole lung lavage—technical details, challenges and management of complications. J Thorac Dis 2017;9(6):1697–706. Doi: 10.21037/jtd.2017.04.10
24. Ramirez JR. Bronchopulmonary Lavage. New techniques and observations. Dis Chest 1966;50(6):581–8. Doi: 10.1378/chest.50.6.581
25. Mata-Suarez SM, Castro-Lalín A, Mc Loughlin S, De Domini J, Bianco JC. Whole-Lung Lavage—a Narrative Review of Anesthetic Management. J Cardiothorac Vasc Anesth 2022;36(2):587–93. Doi: 10.1053/j.jvca.2020.12.002
26. Ra SW, Park SE, Lee HK, Han IS, Park SH. Whole lung lavage using a rapid infusion system to treat a patient with pulmonary alveolar proteinosis. Yeungnam Univ J Med 2020;37(1):67–72.
27. Chauhan S, Sharma K, Bisoi A, Pangeni R, Madan K, Chauhan Y. Management of pulmonary alveolar proteinosis with whole lung lavage using extracorporeal membrane oxygenation support in a postrenal transplant patient with graft failure. Ann Card Anaesth 2016;19(2):379.
28. Baumgärtel M, Würflein D, Neff U, Böhm J, Ficker JH, Swol J. Bridging Whole-Lung Lavage with Venovenous Extracorporeal Life Support for Pulmonary Alveolar Proteinosis. J Cardiothorac Vasc Anesth 2020;34(4):1115–7. Doi:10.1053/j.jvca.2019.08.032
29. Hasan N, Bagga S, Monteagudo J et al. Extracorporeal Membrane Oxygenation to Support Whole-lung Lavage in Pulmonary Alveolar Proteinosis: Salvage of the Drowned Lungs. J Bronchol Interv Pulmonol 2013;20(1):41–4. Doi: 10.1097/LBR.0b013e31827ccdb5
30. Zhou X, Lu G, Yu Z, Gao F, Bian T. Long-term follow-up of whole lung lavage in patients with pulmonary alveolar proteinosis. Exp Ther Med 2014;8(3):763–8.
31. Beccaria M, Luisetti M, Rodi G et al. Long-term durable benefit after whole lung lavage in pulmonary alveolar proteinosis. Eur Respir J 2004;23(4):526–31. Doi: 10.1183/09031936.04.00102704
32. Tazawa R, Ueda T, Abe M et al. Inhaled GM-CSF for Pulmonary Alveolar Proteinosis. N Engl J Med 2019;381(10):923–32. Doi: 10.1056/NEJMoa1816216
33. Campo I, Carey BC, Paracchini E et al. Inhaled recombinant GM-CSF reduces the need for whole lung lavage and improves gas exchange in autoimmune pulmonary alveolar proteinosis patients. Eur Respir J 2024;63(1):2301233. Doi: 10.1183/13993003.01233-2023