
Servio Tulio Torres Rodríguez
https://orcid.org/0000-0001-8914-5588
Danilo Herrera Cruz
https://orcid.org/0000-0001-5694-5984
Sergio Villeda Castañeda
https://orcid.org/0000-0003-1958-4707
Elka Lainfiesta Moncada
https://orcid.org/0000-0003-4051-4172
Hugo González Estrada
https://orcid.org/0009-0009-9717-8211
Orlando Rodas Pernillo
https://orcid.org/0000-0002-8252-3862

CASO CLÍNICO | Respirar, 2024; 16(4): 411-415 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.16.4.9
Recibido:
17 junio 2024
Aceptado
19 agosto 2024
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
Paragonomiasis pulmonar.
Reporte de caso controversial
Pulmonary Paragonomiasis. Controversial Case Report
Servio Tulio Torres Rodríguez1 , Danilo Herrera Cruz1
, Danilo Herrera Cruz1 , Sergio Villeda Castañeda1
, Sergio Villeda Castañeda1 , Elka Lainfiesta Moncada1
, Elka Lainfiesta Moncada1 , Hugo González Estrada1
, Hugo González Estrada1 , Orlando Rodas Pernillo2
, Orlando Rodas Pernillo2
1. Hospital de Referencia Nacional de Enfermedades Respiratorias, Guatemala, Guatemala.
2. Laboratorio de Patología Médica, Patmed, Guatemala, Guatemala.
Autor CORRESPONSAL:
Servio Tulio Torres Rodríguez. stuliotr@gmail.com
Resumen
La infestación por Paragonimus spp. clásicamente se da por la ingestión de crustáceos de agua dulce, crudos, poco cocidos o en forma de ceviches. Se presenta el caso de un paciente adulto que conscientemente ingería cangrejos crudos y desarrolló sintomatología pulmonar con tos y disnea, lo cual lo llevó a efectuarse estudios broncoscópicos cuyo resultado citológico del cepillado bronquial fue de adenocarcinoma pulmonar. Se le realizó biopsia pulmonar y la patología fue concluyente de la presencia de huevecillos y formas larvarias de Paragonimus spp., que es una entidad poco frecuente en Guatemala. El paciente recibió tratamiento con prazicuantel y mostró buena respuesta clínica.
Palabras clave: Paragonimus, cangrejos, pulmón.
Abstract
Infestation by Paragonimus spp. classically occurs through the ingestion of freshwater crustaceans, raw, undercooked or in the form of “ceviches”. We present the case of an adult patient who consciously ingested raw crabs and developed pulmonary symptoms with cough and dyspnea, which leaded him to undergo bronchoscopic studies, whose cytological result of bronchial brushing was pulmonary adenocarcinoma. A lung biopsy was performed and the pathology was conclusive of the presence of eggs and larval forms of Paragonimus spp., which is a rare entity in Guatemala. Patient received treatment with praziquantel and showed a good clinical response.
Keywords: Paragonimus, crabs, lung.
Introducción
La infestación por Paragonimus spp clásicamente se da por la ingestión de crustáceos de agua dulce, vivos, poco cocidos o en forma de ceviches. Una vez ingeridos los crustáceos, los parásitos salen de sus quistes, penetran en la pared intestinal y se desplazan a la cavidad peritoneal. Luego van a través del diafragma, hacia la cavidad pleural, para ingresar en el tejido pulmonar, encapsularse y convertirse en los helmintos adultos hermafroditas que producen huevos.1 También pueden comprometer el encéfalo, el hígado, los ganglios linfáticos, la piel y la médula espinal.
Se presenta el caso de un paciente adulto que conscientemente comía cangrejos vivos y desarrolló sintomatología pulmonar con tos y disnea, lo cual lo llevó a efectuarse estudios broncoscópicos en los que se obtuvo resultado citológico equivocado del cepillado de adenocarcinoma pulmonar. La biopsia pulmonar demostró la presencia de huevecillos y formas larvarias de Paragonimus spp. Se lo trató con praziquantel y obtuvo buena respuesta al medicamento.
Caso clínico
Paciente masculino de 39 años de edad que acudió a hospital departamental con historia de tos y disnea de medianos esfuerzos (Grado 3 en Escala de Borg). Las radiografías (Rx) de tórax mostraron una “mancha” en el pulmón izquierdo y la hematología con recuento de glóbulos blancos en 9,33 +10 ˄3mL, con 49,60% segmentados y 5,6% (0.0-7.0) de eosinófilos. Baciloscopias seriadas de esputo negativo.
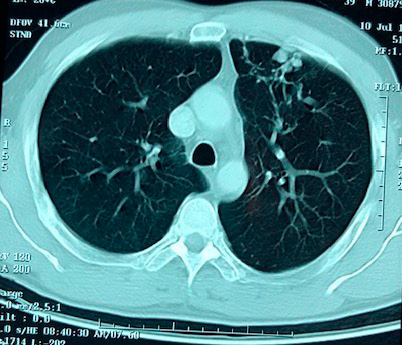
Fue trasladado al Instituto de Cancerología donde se inició la investigación de la lesión pulmonar, comenzando con broncoscopia con lavado y cepillado bronquial que dio como resultado un diagnóstico citológico positivo para abundantes células de adenocarcinoma. Las tinciones para bacilos de Koch y hongos fueron negativas. La tomografía de tórax reportó, en región paracardíaca izquierda, masa triangular de 35 x 20 mm, con densidad de 49 UH, sospechosa de neoplasia; y en lóbulo superior izquierdo, 4 imágenes nodulares de 10 mm de diámetro que podían corresponder a proceso metastásico. El resto de las estructuras intratorácicas normales (Figuras 1a y 1b). Por diagnóstico presuntivo de carcinoma pulmonar, se le realizaron estudios de extensión, con endoscopia gástrica, que mostró esófago y duodeno de aspecto normal. Estómago, a nivel del antro, edema y enrojecimiento de la mucosa que impresionó como gastritis superficial moderada y la anatomía patológica informó: gastropatía crónica con atrofia sin metaplasia intestinal. Helicobacter pylori negativo. La tomografía abdominal total reportó páncreas ligeramente ensanchado a nivel del cuerpo sin lograr evidenciar masas, el resto del estudio no mostró anomalías de órganos intrabdominales. La determinación del biomarcador para Ca 19-9, fue de 13,8 Ul/L (0-40).
Figuras 1a, 1b y 1c.
1a. TAC torácica plano axial, se observa en lóbulo superior izquierdo al menos 4 imágenes nodulares de 10 mm, que puede corresponder a metástasis. 1b. TAC torácica plano axial, se observa en región para cardíaca izquierda imagen triangular ligeramente celular con densidad de 49 UH y mide 35 x 20 mm. 1c. Pieza quirúrgica del lóbulo superior izquierdo que contiene conglomerado de bulas y nódulos.


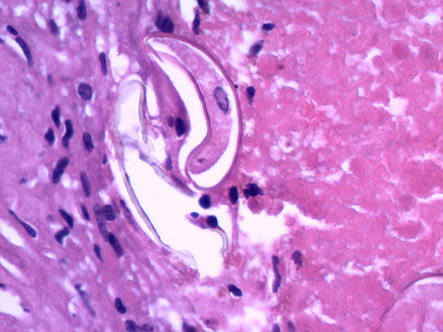
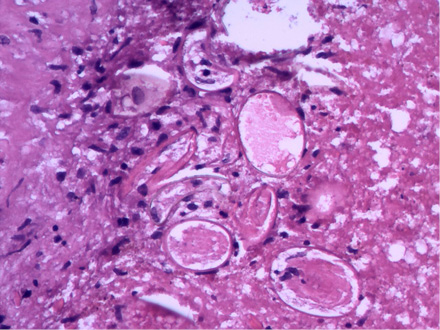
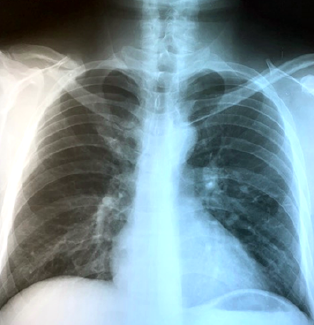
Con los antecedentes referidos y con el fin de tipificar la lesión neoplásica por medio de biopsia pulmonar, el paciente fue recibido en nuestro hospital. Es importante indicar que al interrogatorio clínico mencionó haber consumido cangrejos vivos recientemente. Se le efectuó mini-toracotomía de 4 cm en línea media axilar del hemitórax izquierdo y se encontró lesión periférica con bula de pequeño tamaño en segmento apical del lóbulo superior y, al corte del tejido pulmonar, material de apariencia caseosa. Se envió muestra de 4 x 3 cm a patología. (Figura 1c). Los hallazgos histológicos, incluyendo huevecillos y larvas, fueron compatibles con Paragonimus spp. (Figuras 2a y 2b). El paciente recibió tratamiento con praziquantel, 1 tableta 3 veces al día con intervalo de 6 horas por 3 días. La evolución fue buena y se dio egreso en buenas condiciones generales. La pandemia del Covid-19 impidió darle el seguimiento adecuado, sin embargo, dos años después se presentó en el hospital y la radiografía de tórax posterolateral tomada en ese momento no reveló ninguna anormalidad. (Figura 2c).
Figura 2a, 2b y 2c.
2a. Se aprecia un estado larvario de Paragonimus spp. 2b. Huevecillos formados por cuerpos ovoides de aspecto operculado con presencia de pared birrefringente que en su parte central muestra características del parásito Paragonimus. 2c. Rx de tórax PA, seguimiento a dos años, con evolución radiológica libre de patología
Discusión
Se ha reportado confusión diagnóstica entre paragonomiasis, tuberculosis pulmonar y cáncer de pulmón, por compartir sintomatologías similares.1,2 Esta ambigüedad se da no solo en los aspectos de manifestaciones clínicas de tos, disnea, dolor torácico y hemoptisis, análogos para las tres entidades y donde, en el caso de la paragonomiasis, predomina la tos en el 80 al 100% y la hemoptisis en el 70 al 90%;3-5 sino también en los aspectos radiológicos y tomográficos que para la paragonomiasis pleuropulmonar son derrame pleural, hidro-neumotórax, nódulos pulmonares, consolidaciones y quistes.6,7 En este paciente se encontraron nódulos pulmonares periféricos, quistes de pequeño tamaño y áreas de consolidación paracardíaca que orientaron en un inicio al diagnóstico de neoplasia, reforzado con resultado de citología del lavado broncoalveolar que mostró células de adenocarcinoma. Este diagnóstico no pudo confirmarse, tanto por la falta de hallazgos macroscópicos transoperatorios de lesiones que pudieran relacionarse al cáncer, por la carencia de células neoplásicas y por la radiografía de tórax reportada normal, realizada dos años posterior al tratamiento antiparasitario.
Una historia clínica similar a la nuestra, de un caso simulando cáncer de pulmón, fue reportado. El cáncer de pulmón fue fuertemente sugerido a partir de valores de captación estandarizados determinados en las imágenes FDG-PET; sin embargo, la repetición de la TC de tórax reveló que la lesión había disminuido de tamaño. Posteriormente, se diagnosticó paragonomiasis pulmonar en esputo. Hasta donde sabemos, éste es el primer caso informado de paragonomiasis pulmonar que simula cáncer de pulmón en imágenes FDG-PET.6 Además, la forma larvaria tiene la tendencia a imitar la presentación clínica de las neoplasias malignas y las biopsias tomadas en las regiones subpleurales han sido reportadas sugestivas de cáncer glandular.8 Nosotros tampoco pudimos confirmar el diagnóstico previo de cáncer y, por el contrario, las lesiones se resolvieron con el tratamiento médico.
La paragonomiasis es una enfermedad zoonótica causada por trematodos pulmonares del género Paragonimus spp. Más de 40 millones de personas se infectan con trematodos transmitidos por alimentos y 750 millones corren riesgo de padecer enfermedades tropicales desatendidas.9 Es un parásito común de los crustáceos en Asia3 donde se da el 90% de los casos del mundo.4 Existen alrededor de 50 especies y subespecies de Paragonimus spp. de las cuales al menos entre 9 y 16 especies han sido identificadas que pueden causar infección en humanos.7,10 Después de la Infección oral, entran en la cavidad peritoneal a través de la pared intestinal, migran para finalmente alcanzar la cavidad pleural y el pulmón donde maduran a su etapa adulta y producen sus huevos2,11,12 que pueden ser detectados en esputo, lavado broncoalveolar, heces o secciones histológicas por microscopía o PCR.13
La presencia de trematodos en el pulmón causa hemorragia, inflamación con infiltración leucocitaria y necrosis del parénquima pulmonar que avanza gradualmente hacia el desarrollo de encapsulación fibrótica, excepto por una fístula desde la lesión en evolución hacia el tracto respiratorio. Los huevos de la duela pulmonar salen de la lesión encapsulada a través de la fístula para llegar al esputo y/o heces del huésped, de donde pasan al medio externo y logran la transmisión del parásito.11 Los signos clínicos de la NAP (North American Paroagonomiaisis) humana van desde la eosinofilia asintomática hasta la enfermedad pulmonar grave con derrames pleurales, neumotórax y hemoptisis.13
Los cuatro ejes de enfoque diagnóstico son la serología/inmunología, parasitología, radiología/imágenes médicas y moleculares. La demostración de huevos de trematodos pulmonares en esputo, heces, lavados bronquiales o cirugía con especímenes proporciona un diagnóstico definitivo.2,10
La cirugía normalmente no es apropiada para la paragonimiasis pulmonar no complicada; el tratamiento con praziquantel o triclabendazol debería ser suficiente. Las intervenciones invasivas son más comunes en casos pleurales, especialmente cuando hay derrames pleurales voluminosos que no se han resuelto después del tratamiento farmacológico. A veces también se requiere la decorticación quirúrgica de la pleura para eliminar el material fibroso. La cirugía también es apropiada para casos ectópicos no complicados, especialmente subcutáneos.2
Financiamiento: los autores declaran que el trabajo no tuvo financiamiento.
Conflictos de interés: los autores declaran que no tienen conflictos de intereses relacionados con el tema de esta publicación.
Contribuciones de los autores: STTR: atención primaria de paciente, recolección de información clínica, diseño y redacción del artículo, búsqueda de bibliografía. LDHC, SAVC, EMLM: revisión de artículo, búsqueda de bibliografía. HLGE: atención primaria de paciente, obtención completa de historia clínica. ORP: revisión de artículo, revisión de la patología.
El Editor en Jefe, Dr. Carlos Luna, realizó el seguimiento del proceso de revisión y aprobó este artículo.
Referencias
1. Nakamura-Uchiyama F, Onah DN, Nawa Y. Clinical features of paragonimiasis cases recently found in japan: parasite-specific immunoglobulin M and G antibody classes. Clin Infect Dis 2001;32(12):171–5. Doi: 10.1086/320750.
2. Blair D. Capítulo 5: Paragonimiasis. En: Toledo R, Fried B. Digenetic Trematodes. Advances in Experimental Medicine and Biology. 1era ed., Springer, Nueva York, 2014. pp. 115–52.
3. Kunitomo K, Yumoto S, Tsuji T. Images in Clinical Tropical Medicine A Case of Paragonimiasis in a Patient with Wet Cough. Am J Trop Med Hyg 2020;103(3):939–40. Doi: 10.4269/ajtmh.20-0395.
4. Strobel M, Veasna D, Saykham M et al. Pleuro-pulmonary paragonimiasis. Med Mal Infect 2005;35(10):476–81. Doi: 10.1016/j.medmal.2005.08.002.
5. Curtis KC, Fischer K, Choi YJ, Mitreva M, Weil GJ, Fischer PU. Characterization and localization of antigens for serodiagnosis of human paragonimiasis. Parasitol Res 2021;120(2):535–45. Doi: 10.1007/s00436-020-06990-z.
6. Kim KU, Lee K, Park HK, Jeong YJ, Yu HS, Lee MK. A Pulmonary Paragonimiasis Case Mimicking Metastatic Pulmonary Tumor. Korean J Parasitol 2011;49(1):69–72. Doi: 10.3347/kjp.2011.49.1.69.
7. Lane MA, Barsanti MC, Santos CA, Yeung M, Lubner SJ, Weil GJ. Human paragonimiasis in North America following ingestion of raw crayfish. Clin Infect Dis 2009;49(6):55–61. Doi: 10.1086/605534.
8. Ermilov VV, Smirnov AV, Snigur GL, Dudin RS, Popov SS. Pulmonary larval paragonimiasis mimicking lung cancer. Arkh Patol 2018;80(2):60–3. Doi: 10.17116/patol201880260-63.
9. Sripa B, Kaewkes S, Intapan PM, Maleewong W, Brindley PJ. Food-Borne Trematodiases in Southeast Asia. Epidemiology, Pathology, Clinical Manifestation and Control. Adv Parasitol 2010;72(C):305–50. Doi: 10.1016/S0065-308X(10)72011-X.
10. Maticorena-Agramonte V, Ormeño-Julca A, Coveñas-Coronado C, Polar-Córdova V, Belloso Rodríguez JA. Paragonimiasis pulmonar. Reporte de caso pediátrico. Arch Argent Pediatr 2019;117(6):659–63.
11. Rosa BA, Choi YJ, McNulty SN et al. Comparative genomics and transcriptomics of 4 Paragonimus species provide insights into lung fluke parasitism and pathogenesis. Gigascience 2020;9(7):1–16. Doi: 10.1093/gigascience/giaa073.
12. Yatera K, Hanaka M, Hanaka T et al. A rare case of paragonimiasis miyazakii with lung involvement diagnosed 7years after infection: A case report and literature review. Parasitol Int 2015;64(5):274–80. Doi: 10.1016/j.parint.2015.02.009.
13. Fischer PU, Weil GJ. North American paragonimiasis: Epidemiology and diagnostic strategies. Expert Rev Anti Infect Ther 2015;13(6):779–86. Doi: 10.1586/14787210.2015.1031745.