
Misleidis Sardiñas Aragón
https://orcid.org/0009-0000-3710-9657
Grechen Caridad García León
https://orcid.org/0009-0007-6042-3725
María Rosarys Martínez Romero
https://orcid.org/0000-0001-5947-732X
Raúl Díaz Rodríguez
https://orcid.org/0000-0001-9107-124X
Lilian María Mederos Cuervo
https://orcid.org/0000-0001-7431-2216

ARTÍCULO ORIGINAL | Respirar, 2024; 16(4): 365-372 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.16.4.4
Recibido:
12 junio 2024
Aceptado
11 septiembre 2024
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
Identificación de especies del género Mycobacterium asociadas a infección pulmonar y extrapulmonar
Identification of Species of the Mycobacterium Genus Associated with Pulmonary and Extrapulmonary Infection
Misleidis Sardiñas Aragón , Grechen Caridad García León
, Grechen Caridad García León , María Rosarys Martínez Romero
, María Rosarys Martínez Romero , Raúl Díaz Rodríguez
, Raúl Díaz Rodríguez , Lilian María Mederos Cuervo
, Lilian María Mederos Cuervo
Laboratorio Nacional de Referencia e Investigaciones en Tuberculosis, Lepra y Micobacterias, Centro Colaborador OPS/OMS.
Instituto de Medicina Tropical Pedro Kourí (IPK), La Habana, Cuba.
Autor CORRESPONSAL:
Misleidis Sardiñas Aragón. misle@ipk.sld.cu
Abreviaturas: MNT: micobacterias no tuberculosas, PVVIH: personas viviendo con el virus de inmunodeficiencia humana, BAAR: bacilos ácido alcohol resistente.
Resumen
Introducción: El aumento significativo de especies micobacterianas descritas como agentes patógenos implicó la necesidad de implementar métodos de identificación más avanzados que permitan acortar el tiempo diagnóstico. Desde el punto de vista clínico, es importante diferenciar el complejo Mycobacterium tuberculosis (MTBC) del resto de las especies micobacterianas no tuberculosas (MNT), con el fin de aplicar tratamiento específico.
Objetivo: Identificar aislados micobacterianos procedentes de muestras clínicas pulmonares y extrapulmonares por las técnicas diagnósticas SD BIOLINE TB Ag MPT64 y Genotype Mycobacterium CM/AS.
Material y métodos: Se recibieron 3.604 muestras clínicas procedentes de pacientes sintomáticos durante el período comprendido entre enero 2018–enero 2024. Estas fueron procesadas en el Laboratorio Nacional de Referencia e Investigaciones de Tuberculosis, Lepra y Micobacterias del Instituto de Medicina Tropical “Pedro Kourí” (IPK). Para la identificación de MTBC, se utilizó el test inmunocromatográfico SD TB Ag MPT64; para la identificación de MNT, las técnicas diagnósticas moleculares Genotype Mycobacterium CM/AS.
Resultados: Del total de muestras procesadas, se obtuvieron 325 aislados micobacterianos; 252 (77,53%) identificados como MTBC y 73 (22,45%) especies micobacterianas no tuberculosas. De estas, la de mayor frecuencia de aislamiento fue: Mycobacterium fortuitum 19 (26,02%), Mycobacterium avium 17 (23,80%) y Mycobacterium intracellulare 13 (17,80%).
Conclusiones: Los resultados obtenidos reafirman que los métodos de identificación utilizados son adecuados, ambas técnicas logran el acortamiento del tiempo diagnóstico, lo que permite la implementación temprana del tratamiento adecuado, y así evitar la diseminación de la infección, sobre todo en pacientes con algún tipo de deterioro en su barrera inmunológica.
Palabras clave: complejo Mycobacterium tuberculosis (MTBC), SD BIOLINE TB Ag MPT64, Genotype Mycobacterium CM/AS, micobacterias no tuberculosas.
Abstract
Introduction: The significant increase in mycobacterial species described as pathogenic agents implied the need to implement more advanced identification methods that would shorten the diagnostic time. From a clinical point of view, it is important to differentiate Mycobacterium tuberculosis complex (MTBC) from the rest of the nontuberculous mycobacterial species (NTM), in order to apply specific treatment.
Objective: Identify mycobacterial isolates from pulmonary and extrapulmonary clinical samples using the SD BIOLINE TB Ag MPT64 and Genotype Mycobacterium CM/AS diagnostic techniques.
Materials and methods: 3,604 clinical samples were received from symptomatic patients during the period between January 2018–January 2024. These were processed at the National Reference and Research Laboratory for Tuberculosis, Leprosy and Mycobacteria of the “Pedro Kourí” Institute of Tropical Medicine (IPK). For the identification of MTBC, the SD TB Ag MPT64 immunochromatographic test was used, and for the identification of NTM, the Genotype Mycobacterium CM/AS molecular diagnostic techniques were used.
Results: Of the total samples processed, 325 mycobacterial isolates were obtained; 252 (77.53%) identified as MTBC and 73 (22.45%) nontuberculous mycobacterial species, of which the highest frequency of isolation was: Mycobacterium fortuitum 19 (26.02%), Mycobacterium avium 17 (23. 80%) and Mycobacterium intracellulare 13 (17.80%).
Conclusions: The results obtained reaffirm that the diagnostic methods used are adequate, both techniques achieve a shortening of the diagnostic time, which allows the early implementation of the appropriate treatment, thus avoiding the spread of the infection, especially in patients with some type of deterioration in their barrier immunological.
Keywords: Mycobacterium tuberculosis complex (MTBC), SD BIOLINE TB Ag MPT64, Genotype Mycobacterium CM/AS, nontuberculous mycobacterial
Introducción
La tuberculosis (TB) está presente desde los inicios de la historia de la humanidad. Cada año millones de personas se ven afectadas por esta enfermedad, su incremento se debe en gran medida al aumento de personas viviendo con VIH (PVVIH).1,2
Las micobacterias no tuberculosas (MNT) también juegan un papel importante como agente causal de infecciones en humanos, su sintomatología es similar a la producida por la TB. Las MNT están ampliamente distribuidas en la naturaleza (suelo, aguas contaminadas, animales domésticos, soluciones e instrumentos quirúrgicos, entre otros), la transmisión de persona-persona no está confirmada.3-5
La principal limitante de los métodos convencionales para el diagnóstico es el tiempo de crecimiento (3-8 semanas). Desde el punto de vista clínico-diagnóstico, es muy importante diferenciar el complejo Mycobacterium tuberculosis (MTBC) de las especies MNT, con el fin de aplicar cuanto antes el tratamiento específico. Por lo tanto, se hace necesaria la implementación de métodos de identificación de mayor sensibilidad, como es el caso del análisis inmunocromatográfico SD BIOLINE TB que detecta el antígeno MPT64 segregado por las especies pertenecientes al MTBC durante el crecimiento en el cultivo y es uno de los métodos más recomendados en la literatura.6-10
Para la identificación de MNT, ya existen técnicas de hibridación reversa y tecnología de sonda en línea como los ensayos GenoType Mycobacterium CM y GenoType Mycobacterium AS (Hain Lifescience, Nehren, Alemania).11-13
El objetivo de este estudio fue identificar aislados micobacterianos a partir de muestras clínicas pulmonares y extrapulmonares, utilizando los métodos diagnósticos SD BIOLINE TB Ag MPT64 y GenotypeMycobacterium CM/AS.
Material y métodos
Se realizó un estudio descriptivo, retrospectivo de corte transversal en el período comprendido entre enero 2018 - enero 2024, en el Laboratorio Nacional de Referencia e Investigaciones de Tuberculosis, Lepra y Micobacterias (LNRI-TBLM) del Instituto de Medicina Tropical “Pedro Kourí” (IPK), La Habana, Cuba. Se recibieron y analizaron un total de 3.604 muestras procedentes de pacientes sintomáticos, incluyendo PVVIH. El método de descontaminación se aplicó acorde a lo establecido en los laboratorios de micobacteriología según tipo de muestra. El cultivo se realizó en medio sólido Löwenstein-Jensen, posteriormente se incubó a 37°C, con lecturas semanales durante 8 semanas.14,15
En el caso de que se obtuviera algún crecimiento, se les realizó coloración de Ziehl-Neelsen para verificar la presencia de bacilos ácido alcohol resistente (BAAR). La identificación de MTBC se realizó por el ensayo inmunocromatográfico TB Ag MPT64 Rapid Device (Abbott Diagnostics Korea Inc., Corea del Sur). Para la identificación de especies MNT, se utilizaron los métodos genotípicos GenoType Mycobacterium CM y GenoType Mycobacterium AS, según las normas del fabricante.11-13
Aspectos éticos: Por el tipo de estudio que se realizó, no se requirió de consentimiento informado de los pacientes involucrados en esta investigación. El trabajo se llevó a cabo en cabinas de bioseguridad clase II, según las normas y procedimientos de los laboratorios de micobacteriología. Los nombres de los pacientes involucrados se mantuvieron de manera confidencial. No hubo conflicto de intereses entre los autores. El protocolo de investigación fue evaluado y aprobado por la Comisión Científica Especializada de Microbiología y el Comité de Ética de Investigación-IPK.
Resultados
De las 3.604 muestras pulmonares y extrapulmonares procesadas de pacientes sintomáticos, se obtuvieron 325 (9%) aislados micobacterianos, 252 (77,53%) identificados como MTBC y 73 (22,45%) especies micobacterianas no tuberculosas. La figura 1 muestra los resultados de la frecuencia de aislamiento pertenecientes MTBC y especies de MNT obtenidos en este periodo; como se puede observar, MTBC sigue siendo el mayor agente causal de infecciones en humano tanto pulmonar como extrapulmonar.
Figura 1.
Frecuencia de aislamiento de especies micobacterianas periodo 2018 - 2024.
Complejo Mycobacterium tuberculosis 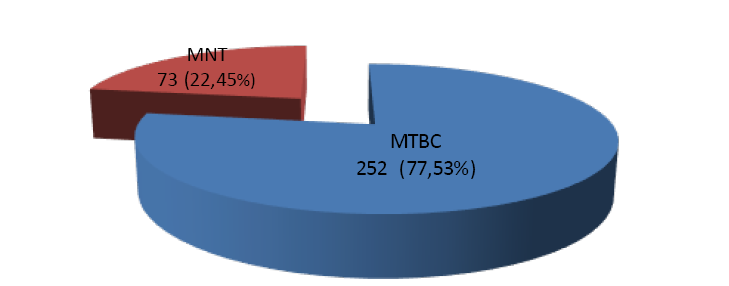
Complejo Mycobacterium tuberculosis Micobacterias no tuberculosis
En la Tabla 1, se muestran los resultados obtenidos de los 73 aislados clínicos de MNT identificados por especies mediante las técnicas Genotype Mycobacterium CM y Genotype Mycobacterium AS. Las especies de mayor frecuencia de aislamiento fueron: M. fortuitum 19 (26%), M. avium 17 (23,3%) y M. intracellulare 13 (17,8%).
Tabla 1.
Resultados de la identificación de los aislados de MNT mediante los métodos moleculares Genotype Mycobacterium CM y GenoType Mycobacterium AS.
|
Especies |
n |
% |
|
M. fortuitum |
19 |
26 |
|
M. avium |
17 |
23,3 |
|
M. intracelullare |
13 |
17,8 |
|
M. chelonae |
7 |
9,6 |
|
M. simiae |
6 |
8,2 |
|
M. smegmatis |
5 |
6,8 |
|
M. scrofulaceum |
3 |
4,1 |
|
M. gastri |
1 |
1,4 |
|
M. abcsessus |
1 |
1,4 |
|
M. kansasii |
1 |
1,4 |
|
Total |
73 |
100 |
La tabla 2 expone el total de especies identificadas según tipo de muestra. Como se puede observar, tanto en muestras pulmonares como extrapulmonares predomina el aislamiento de M. tuberculosis, lo que reafirma que este sigue siendo el mayor agente causal en humano, principalmente en muestras pulmonares.
Tabla 2.
Identificación de especies micobacterianas aisladas según tipo de muestra.
|
Tipo de muestras |
Especies |
n |
% |
|
Esputo (283) |
M. tuberculosis |
219 |
77,38 |
|
M. avium |
13 |
4,59 |
|
|
M. chelonae |
8 |
2,82 |
|
|
M. fortuitum |
18 |
6,36 |
|
|
M. intracellulare |
11 |
3,89 |
|
|
M. scrofulaceum |
2 |
0,71 |
|
|
M. simiae |
6 |
2,12 |
|
|
M. smegmatis |
5 |
1,77 |
|
|
M. abscessus |
1 |
0,35 |
|
|
Lavado bronquial (9) |
M. tuberculosis |
9 |
100 |
|
M. tuberculosis |
7 |
63,64 |
|
|
M. gastri |
1 |
9,09 |
|
|
Biopsias (11) |
M. kansasii |
1 |
9,09 |
|
M. scrofulaceum |
1 |
9,09 |
|
|
M. intracellulare |
1 |
9,09 |
|
|
Liquido pleural (5) |
M. tuberculosis |
5 |
100 |
|
*LCR (1) |
M. tuberculosis |
1 |
100 |
|
Liquido ascitico (1) |
M. tuberculosis |
1 |
100 |
|
M. tuberculosis |
5 |
62,5 |
|
|
Orina (8) |
M. avium |
2 |
25,00 |
|
M. fortuitum |
1 |
12,50 |
|
|
Sangre (2) |
M. avium |
1 |
50,00 |
|
M. intracellulare |
1 |
50,00 |
|
|
Secreción abscesos (4) |
M. tuberculosis |
4 |
100 |
|
Exudado de lesión (1) |
M. tuberculosis |
1 |
100 |
|
Total |
325 |
*LCR, líquido cefalorraquídeo
Discusión
La TB históricamente fue y sigue siendo un importante problema de salud pública. Las herramientas diagnósticas convencionales para la identificación-discriminación entre MTBC y MNT tienen baja sensibilidad. Los frotis para detectar la presencia de BAAR no pueden discriminar MTBC de MNT, y el tiempo de crecimiento en el cultivo es largo, lo que retarda el diagnóstico. Esto llevó a la urgente necesidad de encontrar pruebas diagnósticas de mayor sensibilidad y rapidez.15
Las técnicas analíticas y moleculares, como la amplificación de ácidos nucleicos, genes 16S rRNA, sondas quimioluminiscentes, SM-MALDITOF, entre otras; son métodos costosos y que requieren de mayor preparación del personal técnico-profesional. Por lo tanto, para la detección del MTBC se crea el ensayo “SD BIOLINE TB Ag MPT 64®” que es una prueba diagnóstica rápida y que puede usarse en entornos de laboratorio sin muchos recursos. Pocos autores han informado resultados falsos positivos al evaluar el antígeno MPT64. Sin embargo, también es muy importante identificar el aislamiento micobacteriano con resultado negativo a la prueba del antígeno MPT 64, por cuanto podríamos estar en presencia de una especie micobacteriana no pertenecientes al MTBC, lo que hace que la conducta terapéutica a seguir sea diferente, pues las especies MNT requieren de tratamientos más específicos. La utilización de la prueba de detección rápida de antígeno SD Bioline MPT64 tiene gran potencial y facilita tomar decisiones rápidas y precisas para lograr un mejor manejo clínico de la infección.15
La identificación tradicional de las MNT se basa en el análisis de las características fenotípicas, biológicas y bioquímicas tales como: morfología, velocidad de crecimiento, producción de pigmento, actividad enzimática y la utilización de sustratos. Muchas de estas técnicas requieren varias semanas para obtener sus resultados, lo que atenta contra la necesidad de acortar el tiempo diagnóstico. Por esta razón, actualmente existen técnicas moleculares de mayor sensibilidad y especificidad, las que permiten lograr un diagnóstico rápido y confiable.16
Respecto a los resultados obtenidos, no discrepan de los ya reportados en la literatura científica tanto nacional como internacional, donde la mayor frecuencia de aislamiento corresponde al MTBC. Así, se confirma que este sigue siendo el agente infeccioso más importante dentro del Género Mycobacterium tanto en pacientes inmunocompetentes como inmunodeficientes específicamente los PVVIH, pues este grupo de pacientes presentan un mayor riesgo de infección por el significativo deterioro en su barrera inmunológica.17-19
Las especies micobacterianas aisladas según tipo de muestra pulmonar y extrapulmonar reafirmaron lo anteriormente expuesto, donde MTBC (77,53%) fue el agente infeccioso con mayor porcentaje de aislamiento. Respecto a las especies micobacterianas no tuberculosas, se puede observar que según clasificación de Runyon las de mayor porcentaje de aislamiento fueron: Grupo III (M. avium y M. intracellulare) y Grupo IV (M. fortuitum, M. chelonae), resultados que concuerdan con los ya reportados por otros autores.
La distribución de las MNT sigue parámetros regionales, sin embargo, en la mayoría de las zonas geográficas prevalecen dentro de las especies de crecimiento lento las pertenecientes al complejo M. avium-intracellulare (MAIC). Respecto a las de crecimiento rápido, prevalecen las especies asociadas al complejo M. fortuitum, tanto a infecciones pulmonares como extrapulmonares. Son varios los factores de riesgo que influyen en este tipo de infección; entre ellos, personas con enfermedades preexistentes, factores conductuales como fumadores, consumo excesivo de alcohol, exposición a aerosoles, ingestión o contacto con aguas contaminadas, así como material quirúrgico infectado, factores genéticos que incluyen como fibrosis quística, deficiencias en la producción de proteínas de señalización inmunitaria, además de otras causas. Otro aspecto de interés son los factores de patogenicidad de estos microorganismos.20-23
Ciertamente, la incidencia y prevalencia de las MNT actualmente aumenta significativamente, incluso en personas sin factor de riesgo. El aumento de casos de micobacteriosis coincide mundialmente con el declive de Mycobacterium tuberculosis y la aparición del Virus de Inmunodeficiencia Humana (VIH). Otro factor que ha influido es la aplicación de nuevas técnicas diagnósticas analíticas y moleculares en los laboratorios de micobacteriología que permiten obtener un mayor número de aislamientos microbiológicos e identificación más rápida y exacta.21
Las especies pertenecientes al complejo M. fortuitum son responsables de la mayor parte de las infecciones causadas por micobacterias no pigmentadas de crecimiento rápido (MNPCR). Sin embargo, no son muchos los reportes de estas especies asociadas como patógenos potenciales en piel, tejidos blandos, y otras infecciones extrapulmonares; no porque no existan, sino porque los especialistas no asocian estos casos a infección micobacteriana. Desde el punto de vista clínico, las especies patógenas se consideran oportunistas mayores u oportunistas menores según la mayor o menor incidencia en enfermedad humana.5,22,23
Reportes recientes describen que de 475 aislados de MNT procedentes de biopsias de piel y tejidos blandos, la MNPCR aislada con mayor frecuencia fue M. abscessus 184 (38,7%), seguida por M. fortuitum 150 (31,5%), y M. chelonae con 72 (15%). Otros estudios también describen la aparición de estas especies asociadas a infecciones postquirúrgicas, debido a instrumentación contaminada.24-27
Otros autores han reportado infecciones provocadas por MNT tanto de crecimiento lento como rápido en otorrinolaringología. La TB extrapulmonar más frecuente es en ganglios submaxilar y cervical, conjuntamente también existe un aumento de reportes de casos clínicos de linfadenitis provocados por MNT tanto en pacientes inmunocompetentes como inmunodeficientes.28,29
Más recientemente, otro trabajo analizó 217 aislados de MNT procedentes de pacientes sintomáticos respiratorios; de estos, 91 procedían de PVVIH lo que reafirma que son más susceptibles a este tipo de infección. Las especies con mayor frecuencia de aislamiento fueron M. avium 34 (37,4%) y M. intracellulare 57 (62,6%). La literatura científica describe el significativo aumento del complejo MAI como agente causal de infecciones pulmonares y extrapulmonares.30,31
Conclusiones
Los resultados expuestos anteriormente reafirman que los métodos de identificación utilizados son adecuados. Ambas técnicas logran el acortamiento del tiempo diagnóstico, lo que permite la implementación temprana del tratamiento adecuado. MTB sigue siendo el mayor agente causal de infecciones por micobacterias en humanos. Los especialistas deben efectuar una búsqueda más intensa de este tipo de infección ya sea pulmonar como extrapulmonar y tener en cuenta que estas pueden aparecer tanto en pacientes inmunocompetentes o inmunodeficientes. De esta forma, se puede controlar la infección así como prevenir las peligrosas formas de diseminación que generalmente tienen graves consecuencias, sobre todo en los grupos poblacionales de alto riesgo, en particular en los PVVIH.
Financiamiento: los autores declaran que el trabajo no tuvo financiamiento.
Conflictos de interés: los autores declaran que no tienen conflictos de intereses relacionados con el tema de esta publicación.
Contribución de los autores: MSA: conceptualización, curación de datos, análisis formal, metodología, software, redacción (borrador original), redacción (revisión y edición). LMMC: conceptualización, curación de datos, análisis formal, metodología, software, redacción (borrador original), redacción (revisión y edición). GGL: metodología, software, redacción (revisión y edición). MRMR: metodología, redacción (borrador original), redacción (revisión y edición). RDR: redacción (revisión y edición).
Los Editores en Jefe, Dr. Carlos Luna y Dr. Francisco Arancibia, realizaron el seguimiento del proceso de revisión y aprobaron este artículo.
Referencias