

ARTÍCULO ORIGINAL | Respirar, 2024; 16(3): 271-288 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.16.3.6
Sandra Janete Inwentarz
https://orcid.org/0000-0002-7526-1577
Giovanni Battista Migliori
https://orcid.org/0000-0002-2597-574X
Laura Lagrutta
https://orcid.org/0000-0003-0927-4385
Fernanda Bornengo
https://orcid.org/0009-0006-0161-6677
Jimena Lujan Falco
https://orcid.org/0009-0007-2026-3907
Yanet de Sosa Márquez
https://orcid.org/0009-0004-0603-0769
Carolina Baroni
https://orcid.org/0000-0002-2722-2194
Manuel Eduardo Espinoza Hernández
https://orcid.org/0000-0002-5847-5303
Carlos Peña Martinetti
https://orcid.org/0000-0002-7573-6501
Marisa Vescovo
https://orcid.org/0000-0002-3716-5349
Recibido:
7 marzo 2024
Aceptado
26 julio 2024
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
Recomendaciones para el manejo de la enfermedad pulmonar post tuberculosis
Recommendations for the Management of Post Tuberculosis Lung Disease
Sandra Janete Inwentarz1,2 , Giovanni Battista Migliori3-5
, Giovanni Battista Migliori3-5 , Laura Lagrutta1,2,6,7
, Laura Lagrutta1,2,6,7 , Fernanda Bornengo1,8
, Fernanda Bornengo1,8 , Jimena Luján Falco1,6,9
, Jimena Luján Falco1,6,9 , Yanet de Sosa Márquez10
, Yanet de Sosa Márquez10 , Carolina Baroni11
, Carolina Baroni11 , Manuel Eduardo Espinoza Hernández12
, Manuel Eduardo Espinoza Hernández12 , Carlos Peña Martinetti13
, Carlos Peña Martinetti13 , Marisa Vescovo1,2,6,14
, Marisa Vescovo1,2,6,14
Departamento de Tuberculosis ALAT
1. Universidad de Buenos Aires, Instituto de Tisioneumonologia Profesor Raúl Vaccarezza, Buenos Aires, Argentina.
2. Comité asesor del Programa Nacional de Tuberculosis del Ministerio de Salud de la Nación Argentina.
3. Global Tuberculosis Network (GTN).
4. WHO Collaborating Centre for TB and Lung Disease, Maugeri Care and Research Institute, Tradate, Italia
5. Istituti Clinici Scientifici Maugeri IRCCS, Tradate, Italia
6. Hospital de Infecciosas Francisco Javier Muñiz, Ciudad de Buenos Aires, Argentina.
7. Organización Panamericana de la Salud. Grupo Regional de Tuberculosis Infantil y adolescente de la Región de Las Américas.
8. Clínica Privada Monte Grande, Buenos Aires, Argentina
9. Sanatorio Güemes, Ciudad de Buenos Aires, Argentina.
10. Hospital San José del Callao, Estrategia de Tuberculosis, Carmen de La Legua, Perú.
11. Universidad de Buenos Aires, Hospital de Clínicas, Buenos Aires, Argentina.
12. Pulmonary Health Center, Ciudad Juárez Chihuahua, México
13. Servicio de Salud Metropolitano Central, Programa de Tuberculosis, Santiago, Chile.
14. Organización Panamericana de la Salud, Comité Luz Verde de las Américas.
Autor CORRESPONSAL:
Sandra Janete Inwentarz tuberculosis@alatorax.org
Colaboradores
Isabel Genoveva Salazar. Neumóloga Pediátrica. Vicedirectora del Departamento de Tuberculosis ALAT 2022-2024. Presidente de la Sociedad Ecuatoriana de Neumología Pediátrica 2023-2025. Consultora de Tuberculosis Infantil.
Selene Rocío Manga Chávez. Infectóloga. Médicos Sin Fronteras. USA-NYC-DEI Council. Harvard University SPH Takemi Fellow.
Suyapa Sosa. Neumóloga. Instituto Nacional Cardiopulmonar, Tegucigalpa, Honduras.
Felix Llanos Tejada. Neumólogo. Coordinador de la Estrategia TB- Hospital Nacional Dos de Mayo. Consultor TB MDR. DIRIS Lima Centro. Ministerio de Salud. Docente Investigador. Instituto de Investigaciones en Ciencias Biomédicas. Facultad de Medicina. Universidad Ricardo Palma. Perú.
Carlos Rosero Herrera. Neumólogo, Jefe del Departamento de Tuberculosis y Fibrosis Quística del Hospital Eugenio Espejo, Mgt. Virus VIH, Mgt. BIOÉTICA, Mgt. Gerencia Hospitalaria. Miembro del Comité Nacional de Tuberculosis de Ecuador.
Carlos Colombo Bahr. Neumonólogo. Ex Jefe del Dispensario de Vías Respiratorias. Referente del Programa Provincial del Control de Tuberculosis, Ex Director del Hospital Central de Formosa. Argentina.
Daniel Yumpo Castañeda. Médico Internista - Neumólogo, Asistente-Docente del Hospital Daniel Alcides Carrion de Huancayo y Consultor TB MDR de la Región de salud Junin- Perú.
Leidy Paola Prada Romero. Neumóloga, Medicina Interna y Epidemióloga Clínica. Fundación Neumológica Colombiana
Angelita Cabrera Aguilar. Neumóloga Pediatra. Universidad Central del Ecuador. MSc Procedimientos Avanzados Respiratorios Universidad de Barcelona España. PhD en Medicina e Investigación Traslacional por la Universidad de Barcelona España. Jefe de Servicio del Departamento de Neumología Hospital Pediátrico Baca Ortiz. Vicepresidente de la Comisión Asesora de Prácticas de Inmunización del Ministerio de Salud Pública del Ecuador.
Byron Núñez Freile. Infectólogo. Jefe De Programa Tb. Perú.
Miembros del Departamento de Tuberculosis ALAT
Revisores
Margareth Pretti Dalcolmo
Médica Pneumologista. Miembro titular da Academia Nacional de Medicina. Presidente de la Sociedade Brasileira de Pneumologia e Tisiologia. SBPT. Brasil
Domingo Palmero.
Profesor Titular Neumonología Universidad de Buenos Aires (UBA).
Director Instituto Profesor Dr. Raúl Vaccarezza UBA.
Jefe de División Neurofisiología Hospital de Infecciosas “Francisco Javier Muñiz”. Ciudad de Buenos Aires. Argentina
Carlos Torres Duque
Director, CINEUMO, Centro Internacional de Investigación en Neumología y Salud Respiratoria, Fundación Neumológica Colombiana
Profesor, Universidad de La Sabana
Miembro, Comité Asesor Nacional de Tuberculosis, Ministerio de Salud
Bogotá, Colombia
Ana María Putruele
Profesora Adjunta de la Universidad de Buenos Aires (UBA)
Jefa de la División Neumonología del Hospital de Clínicas José de San Martín.
Vicedirectora de la carrera de especialistas en Neumonología
Ex Directora del departamento de TB de la ALAT
José Antonio Caminero Luna.
Unidad de Tuberculosis y otras micobacteriosis
Servicio de Neumonología
Hospital General Universitario “Dr. Negrín”
Las Palmas de Gran Canaria. España
Director Actividades Científicas ALOSA TB ACADEMY
Resumen
Introducción: Los esfuerzos de la lucha contra la tuberculosis (TB) se centran habitualmente en un diagnóstico precoz y un tratamiento eficaz y oportuno para romper la cadena de transmisión de Mycobacterium tuberculosis. Sin embargo, en los últimos años, coincidiendo con la asociación sindémica TB/COVID-19, han aparecido cada vez más evidencias sobre las graves secuelas clínicas, funcionales y psicosociales que puede ocasionar la TB, condición que se ha definido como enfermedad pulmonar post-tuberculosis (PTLD). Aproximadamente, un tercio de los pacientes que sobreviven a la TB se enfrentan a esto, incluyendo síntomas respiratorios persistentes con exacerbaciones episódicas, insuficiencia respiratoria crónica, trastornos emocionales y desafíos psicosociales que impactan negativamente en la calidad de vida y enfrentan un alto costo catastrófico.
Objetivo: Proporcionar un modelo compartido, orientador y científicamente válido para diagnosticar, evaluar y tratar en forma oportuna a los pacientes con PTLD (prevención, diagnóstico, tratamiento y posible rehabilitación).
Metodología: Es una investigación documental que incluye revisiones sistemáticas, meta-análisis, estudios observacionales y de las directrices existentes en los últimos años al respecto, sumado a una evaluación por expertos en el tema, con el propósito de adaptarlas a las condiciones locales de cada país latinoamericano.
Conclusiones: Considerando la carga mundial, particularmente, latinoamericana de TB, y la carga estimada de la PTLD, se considera urgente el desarrollo de un consenso sobre este tema. Creemos que las recomendaciones de ALAT proporcionarán la base para la formulación y adopción de directrices nacionales para el manejo del PTLD en América Latina.
Palabras claves: enfermedad pulmonar post-tuberculosis, PTLD, tuberculosis, secuelas post tuberculosis.
Abstract
Introduction: Efforts to combat tuberculosis (TB) usually focus on early, rapid diagnosis and effective treatment to break the chain of transmission of Mycobacterium tuberculosis. However, in the last few years, coinciding with the syndemic TB/COVID-19 association, more and more evidence has proved the serious clinical, functional and psychosocial sequelae that TB can cause. This condition has been defined as Post-Pulmonary Disease Tuberculosis (PTLD) and it affects approximately one-third of the patients who survive TB, facing persistent respiratory symptoms with episodic exacerbations, chronic respiratory failure, emotional disorders and psychosocial challenges that negatively impact their life quality, meaning a high catastrophic cost.
Objective: Provide a shared, guiding and scientifically valid model to promptly diagnose, evaluate and treat patients with PTLD (prevention, diagnosis, treatment and possible rehabilitation).
Methodology: It is documentary research that includes systematic reviews, meta-analysis, observational studies and the guidelines that have existed in recent years in this regard, added to an evaluation by experts, with the purpose of adapting them to local conditions of each Latin American country.
Conclusions: Considering the global and, particularly, the Latin American burden of TB, and the estimated burden of PTLD, the development of a consensus document on this topic is urgent. Therefore, we think ALAT recommendations will provide the basis for the formulation and adoption of national specific guidelines for the management of PTLD in Latin America.
Key words: post-pulmonary disease tuberculosis, PTLD, tuberculosis, post tuberculosis sequelae.
Introducción
La tuberculosis (TB) continúa representando un grave problema de salud pública, aun siendo una enfermedad prevenible y curable. La mayoría de las personas que la contraen son adolescentes y adultos jóvenes con alta carga bacilar, en consecuencia, alta probabilidad de diseminación de la enfermedad. Poner fin a la epidemia de tuberculosis es una de las metas de salud de los Objetivos de Desarrollo Sostenible (ODS) de la OMS para 2030, de modo que se plantea la necesidad de revisar todas las estrategias para avanzar en este sentido. Un desafío adicional a las consecuencias físicas y psicosociales negativas es el estigma y los costos catastróficos relacionados con la enfermedad aguda. Se hace cada vez más aparente la relevancia de una condición frecuente, que hasta hace muy pocos años no se le había prestado atención, definida como Enfermedad Pulmonar Post-Tuberculosa (PTLD)1 que aborda las secuelas de la tuberculosis pulmonar y su impacto negativo para los pacientes, sus hogares y comunidades, y para los sistemas de salud.2
La PTLD se definió durante el Primer Simposio Internacional sobre Enfermedad Post-TB, celebrado en Stellenbosch, Sudáfrica, como: “Evidencia de anomalía respiratoria crónica, con o sin síntomas, atribuible, al menos en parte a tuberculosis pulmonar previa”.1-26
Para apoyar el abordaje clínico de los pacientes con PTLD, en 2021 se publicaron unos estándares clínicos mínimos para el diagnóstico, tratamiento y rehabilitación de esta patología.26
La PTLD sigue siendo infradiagnosticada y escasamente abordada, a pesar de que la tuberculosis afecta anualmente a casi 11 millones de personas, niños, adolescentes y adultos en todo el mundo. El segundo Simposio Internacional sobre esta condición en Stellenbosch, Sudáfrica, que tuvo lugar en abril de 2023, contó con la asistencia de médicos expertos, investigadores, financiadores, sobrevivientes y responsables políticos de más de 30 países que pidieron una mayor concientización, promoción, investigación y acción para esta importante enfermedad crónica.
Con el enfoque reciente de incluir bajo el término EPOC cualquier condición causante de obstrucción crónica al flujo de aire, la PTLD puede considerarse como un factor de riesgo para la EPOC o constituirse efectivamente en un subtipo de EPOC.78 Según las guías GOLD 2024, 23 estudios fueron analizados y se obtuvo una odds ratio 2,59 (IC del 95%) con una prevalencia agrupada de EPOC en pacientes con tuberculosis pulmonar previa del 21% (IC del 95%: 16-25%) (224,225). En este sentido, la tuberculosis sería a la vez un diagnóstico diferencial de la EPOC y una comorbilidad potencial.77 Es necesario destacar que se conoce muy poco sobre el comportamiento de la enfermedad obstructiva relacionada con secuelas de tuberculosis: el curso clínico, la ocurrencia de exacerbaciones, la trayectoria de la función pulmonar y su tratamiento, por lo cual es recomendable referirse a secuelas de TB o PTLD con obstrucción al flujo de aire más que a EPOC por TB.
La integración del diagnóstico y el manejo de la etapa “infecciosa aguda” de la enfermedad con la enfermedad crónica “postaguda” debe ser coherente con un enfoque de atención integral de la tuberculosis centrado en la persona, respaldado por la Organización Mundial de la Salud. Este enfoque no solo es deseable, sino crucial para reducir la discapacidad crónica asociada a la enfermedad y sus consecuencias, tales como los costos económicos catastróficos, la discriminación y la vulnerabilidad del paciente.65
Es por este motivo que los miembros del departamento de tuberculosis de la Asociación Latinoamericana de Tórax (ALAT) se han unido para elaborar las siguientes recomendaciones, con el objetivo principal de promover la detección temprana y mejorar la atención del paciente con PTLD y su calidad de vida, así como orientar a los médicos, coordinadores de programas nacionales y funcionarios de salud pública en la planificación e implementación de medidas adecuadas para prevenir y gestionar la PTLD. Asimismo, se pretende fomentar la integración de la atención de estos pacientes dentro de los Programas Nacionales de TB (PNT), con el fin de conseguir el mejor estado de salud posible de los pacientes a corto y largo plazo.
Objetivos
Los objetivos de estas recomendaciones ALAT son:
a) Proporcionar un modelo compartido, orientador y científicamente válido para diagnosticar, evaluar y tratar en forma oportuna a los pacientes con PTLD (prevención, diagnóstico, tratamiento y posible rehabilitación);
b) Definir una guía que estandarice la nomenclatura y los criterios para iniciar un estudio latinoamericano diseñado y responder las preguntas que puedan surgir sobre el tema;
c) Proporcionar la base teórica para el desarrollo de directrices nacionales acerca de la PTLD en los países latinoamericanos;
d) Concientizar a los PNT para que asuman el seguimiento y la orientación para el manejo y los cuidados de los pacientes tras la curación de la TB, asumiendo todos los costos que se deriven del diagnóstico y tratamiento de la PTLD.
Mecanismos inmunológicos asociados a la PLTD
La enfermedad tuberculosa causa destrucción y distorsión del parénquima pulmonar por la inducción y desregulación de diferentes proteasas, citoquinas y mediadores inflamatorios. La respuesta inmune está caracterizada predominantemente por la activación y migración de macrófagos alveolares desde los espacios alveolares hacia el parénquima pulmonar, junto con un reclutamiento de neutrófilos, monocitos, macrófagos, células B, células linfoides innatas, Th1, Th17 y células T CD8+ citotóxicas en el microambiente pulmonar.63
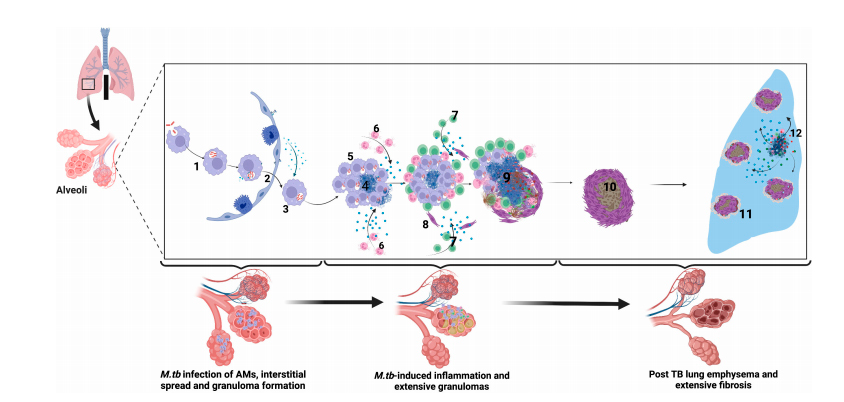
1.Los macrófagos alveolares captan a Mycobacterium tuberculosis (Myc.TB) en el espacio alveolar.
2. Los macrófagos alveolares infectados migran desde el espacio alveolar hacia el intersticio de forma dependiente de IL-1R.
3. Myc TB se replica dentro de los macrófagos alveolares.
4. Myc.TB induce la apoptosis de macrófagos infectados y expresa de proteínas líticas del huésped de manera dependiente de ESX-1.
5. Macrófagos alveolares recién reclutados captan restos celulares infectados.
6. Los neutrófilos infiltrados en el parénquima se mueven mediante quimiotaxis hacia el granuloma en crecimiento, envolviendo las células infectadas y liberan enzimas líticas.
7. Las células T específicas de Myc.TB llegan al granuloma y producen IFN-g para mejorar la actividad microbicida de los macrófagos alveolares. Sin embargo, las células T activadas no pueden acceder al núcleo interno del granuloma y su efecto es amortiguado por la citoquina TGFb.
8. La necrosis de los macrófagos alveolares provoca la rotura del granuloma y la liberación de Myc.TB al espacio extracelular. La inducción posterior de proteínas líticas provoca la cavitación del granuloma y la liberación de Myc.TB en las vías respiratorias.
9. En la etapa post-TB después del tratamiento, la fibrosis pulmonar extensa y el enfisema reducen la distensibilidad pulmonar y se observa reducción de la función pulmonar.
10-11. La calcificación y la fibrosis extensa reduce aún más la distensibilidad pulmonar.
12. Las agresiones periódicas como infecciones bacterianas, virales y fúngicas; contaminación del aire o el tabaco, desencadenan exacerbaciones periódicas con persistencia de la cronicidad.63
El hallazgo histopatológico resultante de la infección incluye la formación de granulomas caseificantes, licuefacción del tejido y formación de cavidades, lo cual conduce a cambios anatómicos permanentes del parénquima de distinta magnitud, incluyendo alteración broncovascular, bronquiectasias y bandas fibróticas cicatrizales, que llevan a una reducción de la capacidad pulmonar total y a facilitar infecciones posteriores por otros microrganismos. Asociado a la distorsión de la vía aérea, se ha encontrado la presencia de hipertrofia e hiperplasia de las glándulas mucosas, aumento de la secreción de moco e hipertrofia del músculo liso, generada por una reacción inflamatoria desencadenada por la infección, con la consecuente disminución del calibre de las vías respiratorias.
Cuanto más se retrasa el diagnóstico de la TB, mayor es la probabilidad de daño pulmonar, por consiguiente, mayor la posibilidad de alteración de la fisiología respiratoria y el deterioro de la calidad de vida.
La PTLD incluye una amplia variedad de secuelas pulmonares funcionales y estructurales que van desde trastornos leves hasta graves como, por ejemplo, la cavitación, las bronquiectasias, el engrosamiento pleural, la fibrosis y la hipertensión pulmonar. Además, los pacientes pueden sufrir colonización e infección por Aspergillus fumigatus, micobacterias no tuberculosas y otras bacterias.1-10-16 Los déficits de función pulmonar descritos en pacientes con PTLD incluyen obstrucción, restricción y patrón mixto, y aproximadamente el 10% de ellos pierden más de la mitad de su función pulmonar.17 De hecho, en comparación con la población general, los pacientes con PTLD tienen dos veces más probabilidades de tener anomalías en la espirometría.18 Como consecuencia de estas secuelas pulmonares, son frecuentes los síntomas respiratorios persistentes como disnea, tos, sibilancias y reducción de la capacidad de ejercicio.19
Aproximadamente un tercio de los pacientes que sobreviven a la tuberculosis pulmonar enfrentan, una vez finalizado el tratamiento, una carga considerable -y a menudo poco reconocida- de morbilidad continua, que incluye insuficiencia respiratoria, infecciones de repetición, desafíos psicosociales y una reducción de la calidad de vida relacionada con la salud.3,4 Incluso, la mortalidad es mayor en los pacientes con PTLD: los estudios indican un riesgo de muerte hasta 6 veces mayor que en la población general.5,6
A pesar del reciente aumento en el número de publicaciones relacionadas con la PTLD, aún no se conoce bien la carga epidemiológica real ocasionada por la PTLD12 y la morbilidad asociada. Se estima que hasta el 50% de los supervivientes de la tuberculosis viven con algún tipo de secuela.20 Además, la tasa de mortalidad en este grupo de pacientes puede ser hasta 3 a 6 veces mayor en comparación con la población general.5,6,21
Según estudios previos, la prevalencia de la PTLD puede variar entre el 18% y el 87% entre pacientes que han tenido TB activa.22 Este rango tan amplio se puede atribuir a los diferentes escenarios analizados y a los diversos parámetros utilizados para diagnosticar PTLD. En una publicación reciente que comparó tres cohortes diferentes de pacientes con PTLD en Brasil, Italia y México, los resultados de las pruebas funcionales pulmonares fueron igualmente variables, con una mayoría de patrones obstructivos, seguido de patrones mixtos y normales.23
Otro estudio utilizó los patrones radiológicos para evaluar la prevalencia de PTLD y los resultados variaron según el tipo de examen (tomografía computarizada versus radiografía de tórax) y según la anomalía residual encontrada: cavitación, bronquiectasias, fibrosis, nódulos, enfisema o consolidación.7,8,24
Las diferentes formas de caracterizar y definir la PTLD dificultan la generalización de los estudios y son pocos los datos que pueden relacionar el daño estructural identificado en las imágenes radiológicas de tórax, el deterioro funcional, los síntomas respiratorios y la calidad de vida. En 2022, en un metaanálisis realizado por Maleche-Obimbo et al. se identificó una prevalencia de 46,7% de alteraciones de la función pulmonar, 41% de síntomas respiratorios persistentes y 64,6% de anomalías radiológicas. La magnitud de cualquier tipo de PTLD variaba según el estado serológico respecto del VIH, los entornos geográficos, los hábitos de fumar y los entornos urbano-rurales.25
Es evidente que la PTLD contribuye al exceso de mortalidad y morbilidad9 causado por TB, puesto que provoca discapacidad funcional, favorece complicaciones como infecciones y hemoptisis, perjudica la calidad de vida y, por lo tanto, aumenta la hospitalización y los costos para los sistemas de salud.
La evaluación y el tratamiento temprano y oportuno de la morbilidad relacionada con la PTLD, guiados por las recomendaciones sólidas de una sociedad científica, son de suma importancia para garantizar la adecuada asignación de recursos a los servicios de tuberculosis, así como también para promover y fomentar diversas actividades de prevención, diagnóstico y tratamiento de la calidad de vida relacionada con la salud.3,4
Por todo lo expuesto, el Departamento de Tuberculosis de ALAT ha decidido publicar este documento, donde se definen y enumeran criterios y recomendaciones de acción para el tratamiento de los pacientes con PTLD de nuestra región.
Evaluación del paciente con enfermedad pulmonar post tuberculosis
Todo paciente que complete el tratamiento contra la tuberculosis debe ser evaluado clínica y radiográficamente para identificar la presencia o no de secuelas posteriores.26 El momento en el que el paciente acaba el tratamiento y se da por curado es ideal para esa evaluación pues está presente en la consulta, no es contagioso y está fuertemente concientizado sobre su enfermedad. Los exámenes recomendados para identificar PTLD incluyen:
Conociendo que muchos servicios de la región no cuentan con todas las pruebas antes mencionadas, se establece que las recomendaciones se deben adaptar a los recursos disponibles, siempre incluyendo el mínimo de evaluación clínica: radiografía de tórax, espirometría, oximetría de pulso y puntuación de síntomas, y cuestionario de calidad de vida.1,4,10,12,22,26-32
Parámetros para evaluar
Historia clínica: anamnesis y examen físico
Los patrones clínicos de la PTLD incluyen un amplio espectro de signos y síntomas que varían desde pacientes asintomáticos hasta la discapacidad respiratoria grave. Algunos de los síntomas que motivan habitualmente las consultas son tos crónica y disnea,33 muchas veces acompañadas de hemoptisis. El examen clínico debe centrarse rutinariamente en tomar la frecuencia respiratoria, la frecuencia cardíaca y el índice de masa corporal.1 También debe incluir una exploración física, que incluya siempre una detallada auscultación pulmonar; analizando si existe disminución del ruido respiratorio normal roncus, sibilancias, estertores, etc., que puedan orientar la presencia de secuelas en el paciente.
Los pacientes con anomalías estructurales residuales pueden presentar exacerbaciones infecciosas e incluso tienen mayor riesgo de sufrir un nuevo caso de tuberculosis.34 Las enfermedades bacterianas, virales, fúngicas y micobacterianas no relacionadas con las tuberculosis, complicadas con hemoptisis posterior, pueden ser graves y potencialmente mortales.7 Los pacientes también experimentan altas tasas de hospitalización y mortalidad relacionada con las vías respiratorias.33
Es de destacar que otros factores, además de las secuelas de la tuberculosis, pueden influir en la PTLD y sus resultados, como la exposición ambiental al tabaquismo, el abuso de sustancias, la biomasa y las enfermedades ocupacionales. Además, las comorbilidades cardiopulmonares y otras enfermedades y situaciones especiales pueden empeorar los resultados posteriores a la tuberculosis, tales como la diabetes (DBT), embarazo, obesidad, etc.1,7,22
Imágenes
Las imágenes del tórax son una herramienta diagnóstica obligatoria e importante en la evaluación de todos los pacientes con PTLD. Deben realizarse al terminar el tratamiento de la TB activa, para definir el daño pulmonar posterior a la enfermedad, tanto en los pacientes con síntomas, como en aquellos asintomáticos, ya que es frecuente que tengan una imagen anormal post tratamiento.35
Tanto la radiografía de tórax como la tomografía computarizada (TC) de tórax son útiles en la evaluación del daño estructural pulmonar.24 Aunque la imagen de TC es mucho más sensible para identificar una amplia gama de anormalidades residuales,24 se deben tener en cuenta la disponibilidad, los costos y el impacto de la radiación para decidir qué opción se adapta mejor a cada caso en particular. En cualquier caso, es obligatoria la radiografía de tórax como estudio de partida para detectar lesiones secuelares.
Los patrones radiológicos más comunes de la PTLD informados en una revisión sistemática fueron cavitación, bronquiectasias y fibrosis. Además, también se pueden observar nódulos, consolidaciones, enfisema, engrosamiento pleural y patrones en mosaico.35 Se recomienda cuantificar la extensión de la enfermedad:
Pruebas de función pulmonar
Espirometría, volúmenes pulmonares (pletismografía) y capacidad de difusión (DLCO)
En 2015, un estudio sobre la carga de la enfermedad pulmonar obstructiva (BOLD) que evaluó la asociación del deterioro funcional pulmonar con antecedentes de tuberculosis, en una gran investigación internacional basada en la población, encontró que la tuberculosis previa se asociaba tanto con la obstrucción del flujo de aire como con la restricción en la espirometría, y debe considerarse como una causa potencialmente importante de la enfermedad obstructiva y función pulmonar reducida.11
Hasta ahora, no existe consenso sobre qué trastorno es más prevalente en personas con secuelas de tuberculosis. Recientemente, una cohorte prospectiva realizada en Malawi mostró que el 34,4% de los participantes tenían una espirometría anormal al final del tratamiento antituberculoso. Después de 3 años, el 27,9% todavía presentaba pruebas de función anormales, en su mayoría de carácter obstructivo (15,8%).33 Deben tenerse en cuenta también los factores genéticos propios de cada paciente.
Es probable que el proceso de curación del pulmón durante y después del tratamiento antituberculoso cause un daño estructural tal que provoque la pérdida de tejido parenquimatoso y una espirometría restrictiva, como fue descripto anteriormente en los mecanismos inmunológicos facilitadores de la fibrosis.63 Los mecanismos que causan la obstrucción del flujo de aire son:
Es por estas razones que se indica la obligatoriedad de realizar una espirometría forzada en todos los pacientes que se curan de una TB pulmonar. Cuando haya algún tipo de alteración en la espirometría, y siempre que sea factible, se recomienda realizar la medición de volúmenes pulmonares (la técnica más usada es la pletismografía) para definir el tipo de patrón funcional: obstructivo, restrictivo o incluso mixto, ya que el tipo de defecto ventilatorio puede ser heterogéneo y variar en diferentes poblaciones.23
Es necesario resaltar también que la disminución de la capacidad de difusión de monóxido de carbono (DLCO) puede ocurrir, incluso, en pacientes con espirometría normal y podría ser una mejor herramienta para la evaluación de la función pulmonar en pacientes con PTLD;36 aunque conlleva una metodología más correlacionarse con las pruebas cardiopulmonares y predecir el consumo de oxígeno cuando la prueba de esfuerzo no está disponible.37 Por ello, en los lugares donde esté disponible, se recomienda complementar la espirometría forzada con la medición de la DLCO.
Prueba de marcha (caminata) de seis minutos
Adicionalmente, se recomienda la realización de la prueba de marcha de seis minutos (6MWT) como parte de la evaluación de los pacientes con PTLD ya que es fácil, económica y sencilla de realizar, muy útil para cuantificar la limitación funcional y diseñar un programa de rehabilitación pulmonar personalizado para los diversos tipos de pacientes con PTLD.38
Análisis de gases en sangre/oximetría de pulso
Se recomienda la medición de la saturación de oxígeno mediante oximetría de pulso en todos los pacientes con PTLD para identificar a los pacientes hipoxémicos. El análisis de gases en sangre arterial, cuando sea posible, complementa la oximetría de pulso.
Las indicaciones de la oxigenoterapia domiciliaria deben ser las mismas que las de las enfermedades crónicas de las vías respiratorias, es decir, PaO2 < 55 mmHg o SpO2 < 88% en aire ambiente o PaO2 entre 56 y 59 mmHg asociada con cor pulmonale y/o hematocrito > 55%.39
Prueba de ejercicio cardiopulmonar
La prueba de ejercicio cardiopulmonar (CPET) proporciona una evaluación global de las respuestas integradoras al ejercicio, involucrando los sistemas cardiovascular, respiratorio, muscular y metabólico durante el esfuerzo, y se considera el estándar de oro para la evaluación funcional cardiorrespiratoria.40
Recientemente, Curry et al..37 encontraron que las correlaciones entre cualquier patrón de función pulmonar, si se mide mediante espirometría, DLCO o incluso pletismógrafo; y el consumo de oxígeno medido con CPTE, considerado el estándar de oro para la medición de la capacidad pulmonar; eran débiles.1 A pesar de su importancia, las pruebas de esfuerzo no siempre están disponibles. Cuando exista disponibilidad, se recomienda la CPET en pacientes con síntomas respiratorios, especialmente disnea y espirometría normal, o cuando exista desproporción entre la magnitud de los síntomas y la magnitud de la alteración funcional. Es igualmente útil para cuantificar la discapacidad en pacientes con PTLD que requieren definir su condición laboral.
Evaluación de la hipertensión pulmonar-HTP
Es importante en el diagnóstico y seguimiento de estos pacientes, la evaluación cardiológica en la medida de lo posible, junto con una buena interpretación de la radiografía de tórax, la TC, el electrocardiograma y, de ser necesario, un ecocardiograma Doppler para evaluar la presencia o no de HTP. La hipertensión pulmonar sigue siendo una secuela poco estudiada debido a los desafíos que presenta su diagnóstico. Un estudio de 693 pacientes con HTP del grupo 3 encontró que la tuberculosis previa representaba el 38,8% de los casos y se constató, además, la presencia de arritmias ventriculares.69-70
Recomendamos la realización de una evaluación cardiológica que incluya ECG y, en lo posible, ecocardiograma Doppler color en todos los pacientes con PTLD, principalmente en aquellos que inicien tratamiento de rehabilitación.69-70
Puntuación de síntomas y cuestionarios de calidad de vida.
Datos publicados recientemente sugieren que la frecuencia de alteraciones en la función pulmonar post tratamiento de la TB es cada vez mayor. Los supervivientes tienen de dos a cuatro veces más probabilidades de tener una función pulmonar anormal persistente que las personas que nunca han tenido tuberculosis. Otros estudios han documentado la persistencia de los síntomas respiratorios y una reducción de la función pulmonar y la calidad de vida relacionada con la salud, a pesar de la finalización exitosa del tratamiento de la TB en adultos, adolescentes y niños.66
También hay cada vez más evidencia de morbilidad psicosocial adversa y deterioro socioeconómico persistente67 entre los sobrevivientes de tuberculosis ya que la enfermedad y sus secuelas alteran las actividades diarias de los pacientes, lo que genera un aumento de los costos catastróficos. Una mejor comprensión del impacto económico de la enfermedad, más allá del final del tratamiento y las intervenciones para proteger los medios de vida de los sobrevivientes, deben ser componentes integrales de los esfuerzos de control de la tuberculosis.68
Aún no se dispone de una puntuación de gravedad específica para los pacientes con PTLD, pero existe consenso sobre la urgencia de un sistema de puntuación que evalúe la mortalidad, la calidad de vida relacionada con la salud, la tasa de deterioro de la función pulmonar, las exacerbaciones/hospitalizaciones y la recurrencia de la tuberculosis.1
Se encuentran disponibles diferentes cuestionarios de calidad de vida relacionada con la salud que deben usarse en el seguimiento de pacientes con PTLD, como el Cuestionario respiratorio de St. George, la Encuesta de salud de formato corto (SF12/SF36), la Escala de rendimiento de Karnofsky, la Prueba de evaluación de la EPOC y otros como el Chronic obstructive pulmonary disease Assessment Test (CAT).1 ,26 Se recomienda que los centros de atención de pacientes con PTLD utilicen sistemáticamente alguna de estas herramientas para la evaluación inicial y el seguimiento objetivo de las intervenciones terapéuticas.
Consideraciones específicas para la población infantil y adolescente
En población pediátrica y adolescente, también se observaron secuelas de variable gravedad. Un estudio prospectivo encontró que los niños que desarrollaron TB fueron más propensos a tener sibilancias. Aquellos afectados antes del año de vida tenían evidencia de una enfermedad obstructiva, mientras que aquellos afectados entre el año y los 5 años presentaban una alteración del volumen corriente.71 La evaluación al final del tratamiento debe seguir las mismas recomendaciones propuestas para adultos. La TC de tórax, si bien no está indicada de rutina debido a la exposición a la radiación, puede considerarse en casos con síntomas crónicos y hallazgos radiológicos dudosos para evaluar la extensión de la enfermedad y/o excluir otros diagnósticos. Cabe aclarar que, al usar equipos tomográficos modernos, la exposición a la radiación es mucho menor.
Se debe considerar la realización de pruebas de función pulmonar en aquellos niños mayores de 4 a 5 años que sean capaces de hacer las maniobras respiratorias después de haber finalizado el tratamiento para la TB, independientemente de la gravedad de la enfermedad. La oscilometría de impulso, disponible en algunos centros en Latinoamérica, se puede realizar en niños desde los 3 años ya que no requiere maniobras forzadas y puede aportar información valiosa sobre la alteración funcional en este grupo de niños.
En niños mayores de 4 años, la capacidad de ejercicio se puede evaluar mediante la 6MWT. Los cuestionarios de calidad de vida como el EQ-5D-Y y el Toddler and Infant (TANDI) se pueden utilizar con adaptaciones locales para niños más pequeños.26
En conclusión, recomendamos realizar estudios de función pulmonar, evaluación cardiológica y cuestionarios de calidad de vida para la evaluación y el seguimiento de los niños con sospecha y/o confirmación de PTLD.66
Manejo de la PLTD
Si bien son escasas aún las directrices basadas en evidencia para el tratamiento de la PTLD, sugerimos lo siguiente para todos los grupos etarios, teniendo en cuenta los síntomas que presente el paciente, los resultados de los cuestionarios de calidad de vida, las imágenes y las pruebas de función pulmonar:
Tratamiento inhalado
Para aquellos con alteración funcional obstructiva establecida, los broncodilatadores inhalados pueden ser útiles para reducir la disnea y tal vez incluso para prevenir una disminución de la función pulmonar.7 A pesar de la ausencia de evidencia para la recomendación rutinaria de broncodilatadores en el paciente con PTLD, estudios pequeños sugieren que los agonistas beta de acción prolongada y los antagonistas muscarínicos de acción prolongada podrían mejorar la función pulmonar, la disnea y por ende la calidad de vida.7,24
Siguiendo las recomendaciones aplicadas a las bronquiectasias no secundarias a fibrosis quística, en algunos casos de hiperreactividad bronquial asociada a la PTLD, puede estar justificado el tratamiento con corticosteroides inhalados.24 De manera similar, para la inflamación crónica en pacientes con bronquiectasias podría estar indicado el uso de profilaxis con macrólidos, si presentan al menos dos exacerbaciones por año.39 Como parte del manejo de estos pacientes con PTLD, se recomienda tener en cuenta el historial de enfermedades respiratorias preexistentes, como asma y EPOC, de exposiciones a tabaco, biomasa o de carácter ocupacional, que podrían influir y/o alterar la evolución y la respuesta al tratamiento de la PLTD.
Manejo de las complicaciones infecciosas
El abordaje clínico de las exacerbaciones de etiología infecciosa debe ser el mismo que el aplicado para las bronquiectasias no secundarias a fibrosis quística.39
En las infecciones de pacientes con PTLD, se pueden encontrar aislamientos de:
La infección y/o colonización causada por los diferentes gérmenes puede agravar la enfermedad y provocar mayor riesgo de exacerbaciones, hospitalización, mala calidad de vida, deterioro rápido de la función pulmonar e incluso la muerte, dependiendo del tipo de secuelas que presente el paciente.
La colonización por múltiples microorganismos es común y la resistencia a los antibióticos es una preocupación en aquellos pacientes que puedan requerir el uso frecuente de este tipo de medicamentos para el tratamiento de las exacerbaciones. La colonización con organismos resistentes a múltiples fármacos puede conducir a la inflamación crónica de la vía aérea de bajo grado. Esta inflamación puede progresar, causar exacerbaciones recurrentes y empeorar la limitación del flujo aéreo en las pruebas de función pulmonar.62
Además de las infecciones respiratorias de etiología bacteriana y virales, las complicaciones fúngicas son frecuentes en las secuelas pulmonares de la tuberculosis. Las especies de Aspergillus pueden presentarse de diferentes formas y severidad, desde la colonización en forma de bola fúngica (aspergiloma) hasta la infiltración del parénquima pulmonar y/o tejido pleural con destrucción y nuevas cavidades (aspergilosis broncopulmonar crónica).7,32 Los criterios diagnósticos para esta última presentación incluyen la presencia de síntomas respiratorios durante al menos 3 meses, hallazgos radiográficos sugestivos y evidencia serológica o microbiológica de Aspergillus. El tratamiento de los aspergilomas en pacientes asintomáticos podría ser sólo de “observación”, pero en casos con múltiples episodios de hemoptisis se debe valorar el manejo quirúrgico. Por otro lado, la invasión y destrucción del parénquima pulmonar requiere la aplicación de un tratamiento antifúngico.32 Los antifúngicos orales a largo plazo como itraconazol en dosis de 400 mg/día o voriconazol en dosis de 400 mg/día, administrados durante al menos 6 meses, son el tratamiento de primera línea recomendado para la aspergilosis pulmonar crónica y se asocian con una mejora en la calidad de vida, alivio de los síntomas y retraso en la progresión de la enfermedad.43
Cabe tener en cuenta que, ante la probabilidad de sobreinfección que estos pacientes enfrentan, se recomienda el uso responsable de antibióticos y, en lo posible, aislar el agente infeccioso causal para prevenir la aparición de resistencia bacteriana.
Es importante conocer que el paciente con PTLD, principalmente en los dos años posteriores a la finalización de su tratamiento, puede presentar una recaída/recidiva de su enfermedad tuberculosa. Se recomienda hacer la búsqueda activa y sistemática de Mycobacterium tuberculosis por diferentes métodos, preferentemente los moleculares, ante la aparición de síntomas compatibles.
Sin embargo, puesto que algunos pacientes pueden persistir con la prueba molecular positiva sin tener bacilos viables y sin enfermedad tuberculosa activa, es necesario hacer un análisis juicioso de la clínica, las imágenes, los cultivos para micobacterias y las explicaciones alternativas de los síntomas para sustentar el diagnóstico de recaída por TB.
Rehabilitación pulmonar
Los pacientes con hallazgos clínicos, funcionales o imagenológicos compatibles con PTLD deben ser evaluados para iniciar rehabilitación pulmonar (RP) lo antes posible.26
La rehabilitación pulmonar es un tratamiento no farmacológico en el que interviene un equipo multidisciplinario destinado a pacientes pulmonares crónicos.
Los objetivos principales de esta indicación son:
• Reducir síntomas.
• Incrementar la tolerancia al ejercicio.
• Mejorar y mantener el máximo grado de independencia y funcionamiento en la comunidad.
• Estabilizar o revertir manifestaciones sistémicas de la enfermedad.
• Mejorar la calidad de vida.
La tolerancia al ejercicio se ve beneficiada por la mejoría de la capacidad aeróbica, la mejoría de la función de los músculos ventilatorios, la desensibilización de la disnea, el incremento de la motivación y la mejoría de la técnica de ejecución de los movimientos.64
En resumen, las indicaciones para la RP incluyen: pacientes con función pulmonar deteriorada que muestran obstrucción al flujo de aire, restricción o anomalías mixtas y/o respuesta broncodilatadora y/o capacidad de difusión alterada de monóxido de carbono;44 gases en sangre anormales PaO2 < 80 mmHg (< 60 a gran altitud) y/o PaCO2 > 45 mmHg y/o desaturación nocturna e inducida por el ejercicio;5 capacidad de ejercicio deteriorada;1,38,46,47 síntomas respiratorios persistentes (disnea, tos, esputo, sibilancias, dolor torácico, fatiga);48-51 tos ineficaz y/o secreciones bronquiales difíciles de eliminar;52,53 al menos una hospitalización o dos exacerbaciones en los últimos 12 meses;1,28,54,55 presencia de condiciones comórbidas, incluyendo enfermedad pulmonar obstructiva crónica, asma, bronquiectasias, fibrosis pulmonar, hipertensión pulmonar y/o necesidad de cirugía;11,18,56 y deterioro de la calidad de vida.57-59
Indicaciones de rehabilitación pulmonar en la PLTD
• Función pulmonar deteriorada que muestra obstrucción o restricción del flujo de aire o anomalías mixtas y respuesta broncodilatadora y/o DLCO alterada;
• Gasometría anormal PaO2 < 80 mmHg (< 60 a gran altitud) y/o PaCO2
• > 45 mmHg y/o desaturación nocturna e inducida por el ejercicio;
• Capacidad de ejercicio deteriorada;
• Síntomas respiratorios persistentes (disnea, tos, esputo, sibilancias, dolor de pecho, fatiga);
• Tos ineficaz y/o secreciones bronquiales difíciles de eliminar;
• Al menos 1 hospitalización o 2 exacerbaciones en los últimos 12 meses;
• Presencia de condiciones comórbidas, incluyendo enfermedad pulmonar obstructiva crónica, asma, bronquiectasias, fibrosis pulmonar, hipertensión pulmonar y/o necesidad de cirugía;
• Calidad de vida deteriorada.
El programa de RP debe coordinarse de acuerdo con la organización local de servicios de salud considerando criterios de factibilidad, efectividad y costo-efectividad.26 Los componentes centrales de un programa de rehabilitación deben considerar:
• Ejercicios aeróbicos: entrenamiento de resistencia.
• Entrenamiento de fuerza: extremidades superiores e inferiores.
• Entrenamiento de los músculos inspiratorios.
• Técnicas de limpieza de las vías respiratorias.
• Terapia de oxígeno a largo plazo.
• Ventilación mecánica no invasiva nocturna de larga duración.
• Soporte nutricional.
• Apoyo psicológico.
La evaluación de la eficacia de la rehabilitación pulmonar debe realizarse comparando las variables analizadas antes y después de la rehabilitación.26-64
Manejo quirúrgico de las complicaciones
La PTLD es de presentación heterogénea, puede ser grave y desafiante tanto en pacientes susceptibles a los medicamentos como en aquellos infectados por cepas resistentes de Mycobacterium tuberculosis, tanto monorresistentes como MDR y/o XDR, y pueden requerir un enfoque multidisciplinario para un mejor manejo; más aún en aquellos que presenten secuelas extensas, sobreinfecciones o episodios de complicaciones como puede ser la hemoptisis, en las cuales el manejo médico de las mismas puede no ser suficiente.72
Las diferentes manifestaciones varían desde la presencia de secuelas destructivas con cavitación (única o múltiples), bronquiectasias, infiltrados nodulares, cambios fibróticos, hasta la discapacidad pulmonar (PIAT en inglés); esta última caracterizada por alteraciones ventilatorias obstructivas, restrictivas o mixtas y del intercambio de gases producto de la remodelación pulmonar.76
Una de las manifestaciones más graves y con alto riesgo de mortalidad es la presencia de hemoptisis. Se puede escoger entre el manejo conservador (si la hemoptisis no es amenazante para la vida), procedimientos como la embolización de arterias bronquial o, incluso, la resección quirúrgica de la lesión causal. Todo ello dependiendo de la magnitud de la hemoptisis, la etiología del sangrado, la presencia de lesión única y localizada, y el estado funcional del paciente.
En la bibliografía, se revisaron distintos artículos sobre el manejo quirúrgico de la tuberculosis; las guías de la OMS establecieron las indicaciones y contraindicaciones para esto.
Las intervenciones quirúrgicas pueden ser:
• De emergencia (condiciones que ponen en peligro la vida).
• Urgente (TB irreversible y hemoptisis).
• Electiva.73
Las indicaciones de cirugía electiva incluyen formas unilaterales localizadas de enfermedad confirmada bacteriológicamente, enfermedad cavitaria, TB-MDR/XDR sin tratamiento médico y complicaciones/secuelas: espontáneas neumotórax/ pioneumotórax; empiema pleural con o sin fístula broncopleural, aspergiloma; fístula nodular-bronquial; broncolito; y paquipleuritis/pericarditis con trastornos respiratorios, estenosis de tráquea/bronquio fuente y bronquiectasias post TB.72-73 La resección pulmonar tiene indicación de emergencia solo en caso de hemoptisis masiva en presencia de cavidad pulmonar o bronquiectasias.
Las directrices ATS/CDC/ERS/IDSA propusieron evaluar las prioridades para la cirugía en TB: momento ideal para la cirugía; regímenes farmacológicos óptimos y duración antes y después de la cirugía; el papel de la cirugía en poblaciones especiales y pacientes con comorbilidades (por ejemplo, coinfección por VIH), enfoques quirúrgicos óptimos, medidas óptimas de control de infecciones que se implementarán peri operatoriamente, y el papel de la rehabilitación pulmonar ya que se recomienda que los pacientes sean candidatos aptos para rehabilitación pulmonar.73-74
Contraindicaciones 73-74
• Cavidades bilaterales y extensas;
• Función pulmonar deteriorada (volumen espiratorio forzado en un segundo FEV1 (volumen espiratorio forzado en 1 s) <1,5 L para lobectomía y <2,0 L para neumonectomía);
• Insuficiencia cardíaca pulmonar III-IV (clasificación funcional de la Asociación Cardiológica de Nueva York);
• Índice de masa corporal (IMC) hasta entre el ٤٠٪ y el ٥٠٪ de la normalidad;
• Condiciones comórbidas graves (diabetes no controlada, exacerbación de úlceras y problemas hepáticos/renales);
• TB bronquial activa.
Las guías son consistentes al recomendar la cirugía en casos seleccionados, siempre luego del tratamiento farmacológico. Recomiendan la resección pulmonar parcial electiva, cuando sea posible, según criterios específicos como ser: fracaso del tratamiento farmacológico, recaída, tuberculosis pulmonar localizada (p. ej., cavidad) o extensa, complicaciones clínicas (p. ej., hemoptisis o empiema).74-75
Vacunación
La PTLD, al igual que otros trastornos respiratorios crónicos, puede tener complicaciones infecciosas y algunas de ellas son prevenibles con vacunas, por lo que se recomienda la vacunación contra la influenza, el neumococo, pertussis y la COVID-19 en todos los pacientes con PTLD. (Tabla 1).
La vacuna contra la influenza debe repetirse anualmente, sean parte o no de las campañas de vacunación locales. Para la prevención del neumococo, se recomienda la vacuna neumocócica conjugada 13 valente (PCV13) que tiene un efecto inmunogénico más fuerte, y un año después, la vacuna antineumocócica polisacárida 23 valente (PPSV23) que puede reforzarse con una segunda dosis administrada a los 5 años.24 Disponemos actualmente de la vacuna antineumocócica 20 valente (PCV20) y se puede utilizar en forma indistinta con la PCV13.
Además, existen algunas vacunas recomendadas para la población general (o grupos de edad específicos) de las cuales los pacientes con la PTLD probablemente se beneficien, como el tétanos, la difteria, la tosferina, el sarampión y el herpes zóster. Se recomienda la vacunación contra el sarampión si no hay evidencia de inmunidad en aquellos pacientes nacidos antes de 1957, sin documentación de recepción de la vacuna MMR/SRP [sarampión, rubéola, paperas], evidencia de laboratorio de inmunidad o enfermedad y en aquellos países donde aún hay circulación del virus.
Los pacientes con la PTLD mayores de 50 años también pueden beneficiarse de la vacunación contra el herpes zóster. La vacuna triple bacteriana acelular (tétanos, difteria y tosferina) se recomienda para la población general y debe considerarse en pacientes con la PTLD no vacunados previamente o con alto índice de transmisibilidad regional. Además, la dosis de refuerzo debe repetirse en todos los adultos cada diez años.60 Por lo tanto, considerando la relevancia epidemiológica de PLTD, el papel de la vacunación tiene una contribución importante en la prevención de complicaciones y/o en la mitigación de sus efectos deletéreos.
La vacunación contra el virus respiratorio sincitial (VRS) también se ha propuesto como prioridad de investigación operativa en pacientes con PTLD.60-77 Se recomienda su uso en mayores de 60 años con compromiso pulmonar crónico, en los cuales el riesgo de complicaciones por infección por el VRS es mayor.
La inmunización de pacientes con PTLD con las vacunas disponibles como inductores primarios de la respuesta inmune o con dosis de refuerzo ha ido acompañada de beneficios considerables. En definitiva, dado que el PTLD como entidad respiratoria crónica afecta al sistema respiratorio, la vacunación contra infecciones respiratorias prevenibles podría limitar eficazmente las infecciones secundarias y una mayor evolución del daño del PTLD. Por lo tanto, la vacunación merece ser considerada entre las estrategias para prevenir y/o mitigar el impacto negativo de la PTLD, reforzando las recomendaciones existentes para la población general y enfatizando la necesidad de ampliar la cobertura de vacunas para los pacientes con PTLD independientemente de su edad.60-77
Tabla 1.
Vacunación recomendada
|
Germen |
Indicación |
|
Influenza |
Anualmente, 0,50 ml-menores de 3 años 2 dosis de 0,25 ml intervalo de 1 mes |
|
Neumococo |
PCV 20 o PCV 13 + PPSV 23 al año//PCV 23 dosis intervalo 5 años |
|
COVID-19 |
2 dosis iniciales + refuerzos semestrales |
|
Pertussis |
Dosis de la infancia o 3 dosis iniciales con intervalos de 4 meses y refuerzos cada 10 años |
|
Herpes Zoster |
RZV 2 dosis iniciales en ≥ 50 años |
|
Difteria |
Dosis de la infancia o 3 dosis iniciales con intervalos de 4 meses y refuerzos cada 10 años |
|
Tétanos |
Dosis de la infancia o 3 dosis iniciales con intervalos de 4 meses y refuerzos cada 10 años |
|
MMR/SRP |
Según epidemiología regional |
|
VSR |
1 dosis en mayores de 60 años. |
PCV13, vacuna antineumocócica conjugada 13 Valente. PCV20, vacuna antineumocócica conjugada 20 Valente.PPSV23, vacuna antineumocócica polisacárida 23 serotipos. MMR/SRP, sarampión, rubéola, paperas. VSR, Virus Respiratorio Sincitial.
Educación y asesoramiento para pacientes con PTLD
Se debe educar a los pacientes y su familia acerca de los principios básicos de la enfermedad (epidemiología, aspectos clínicos, transmisión, diagnóstico y tratamiento), los síntomas comunes que pueden experimentar después de una enfermedad aguda, cómo monitorear y manejar sus síntomas en casa, y cuándo deben acudir a un centro de salud; cuáles son los riesgos de reinfección y cómo pueden manejar este riesgo.
Además, se debe aconsejar a los pacientes sobre los beneficios de un estilo de vida saludable que contemple la realización de actividad física, una nutrición adecuada, cesación del hábito tabáquico y otras adicciones. Respecto de este punto, es recomendable asesorar al paciente acerca de las complicaciones que sobrevienen con la persistencia de este hábito sobre la función pulmonar y las áreas con secuelas. Se pueden utilizar sistemas de telesalud, talleres, vídeos y folletos educativos. La consejería/educación en salud debe incluir el mantenimiento de los resultados obtenidos con la RP, a través de un plan de seguimiento.26,61
En resumen, los exámenes mínimos recomendados para identificar PTLD son:
• Historia clínica y examen físico.
• Radiografía de tórax.
• Espirometría.
• Oximetría de pulso.
• Puntuación de síntomas y cuestionario de calidad de vida (CdV).
Próximos pasos del Departamento de Tuberculosis ALAT para PTLD
• Publicación de estas recomendaciones en la Revista Respirar;
• Publicación de estas recomendaciones en el sitio web de ALAT con libre acceso;
• Promoción del documento destinado a promover la atención sobre el PTLD y su manejo clínico;
• Realizar un estudio multicéntrico y latinoamericano para responder a algunas áreas prioritarias para las cuales se necesita evidencia;
• Apoyar la formulación de directrices nacionales para el manejo integral del paciente con PTLD, promoviendo la inclusión de este en los Programas Nacionales de TB.
Financiamiento: los autores declaran que el trabajo no tuvo financiamiento.
Conflictos de interés: los autores declaran que no tienen conflictos de intereses relacionados con el tema de esta publicación.
Contribuciones de los autores: todos los autores contribuyeron de manera equitativa en la escritura, revisión y edición.
El Editor en Jefe, Dr. Francisco Arancibia, realizó el seguimiento del proceso de revisión y aprobó este artículo.
Referencias