

ARTÍCULO ORIGINAL | Respirar, 2024; 16(1): 5-15 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.16.1.1
Recibido:
29 septiembre 2023
Aceptado
5 enero 2024
Francisco E. Arancibia
https://orcid.org/0000-0001-5429-5420
Gustavo Zabert
https://orcid.org/0000-0001-9937-4464
Fernando Rainieri
https://orcid.org/0000-0003-0405-0294
Javier Osatnik
https://orcid.org/0000-0002-4910-1123
Mariano Esperatti
https://orcid.org/0000-0003-3098-9393
Claudia Sepúlveda
https://orcid.org/0009-0009-3570-4888
Ignacio Zabert
https://orcid.org/0000-0002-8693-5901
Daniel Ivulich
https://orcid.org/0000-0002-3614-9064
Carlos M. Luna
https://orcid.org//0000-0002-9288-096X
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
Impacto de la edad, las comorbilidades y las complicaciones en pacientes con COVID-19 con síndrome de dificultad respiratoria aguda en la ventilación mecánica invasiva. Estudio multicéntrico observacional
Impact of Age, Comorbidities and Complications in COVID-19 Patients with Acute Respiratory Distress Syndrome on Invasive Mechanical Ventilation. An Observational Multicenter Study
Francisco E. Arancibia1 , Gustavo Zabert2
, Gustavo Zabert2 , Fernando Rainieri3
, Fernando Rainieri3 ,
,
Javier Osatnik4 , Mariano Esperatti5
, Mariano Esperatti5 , Claudia Sepúlveda1
, Claudia Sepúlveda1 , Ignacio Zabert2
, Ignacio Zabert2 , Daniel Ivulich4
, Daniel Ivulich4 , Carlos M. Luna3
, Carlos M. Luna3
1. Instituto Nacional del Tórax, Santiago de Chile, Chile
2. Clínica Pasteur, Neuquén, Argentina
3. Hospital de Clínicas, Universidad de Buenos Aires, Ciudad Autónoma de Buenos Aires, Argentina
4. Hospital Alemán, Buenos Aires, Argentina
5. Hospital de la Comunidad, Mar del Plata, Buenos Aires, Argentina
Autor CORRESPONSAL:
Carlos M. Luna MD, PhD., dr.cm.luna@gmail.com
Resumen
Objetivos: Millones de pacientes con COVID-19 fueron internados en terapia intensiva en el mundo, la mitad desarrollaron síndrome de dificultad respiratoria aguda (SDRA) y recibieron ventilación mecánica invasiva (VMI), con una mortalidad del 50%. Analizamos cómo edad, comorbilidades y complicaciones, en pacientes con COVID-19 y SDRA que recibieron VMI, se asociaron con el riesgo de morir durante su hospitalización.
Métodos: Estudio de cohorte observacional, retrospectivo y multicéntrico realizado en 5 hospitales (tres privados y dos públicos universitarios) de Argentina y Chile, durante el segundo semestre de 2020.
Se incluyeron pacientes >18 años con infección por SARS-CoV-2 confirmada RT-PCR, que desarrollaron SDRA y fueron asistidos con VMI durante >48 horas, durante el segundo semestre de 2020. Se analizaron los antecedentes, las comorbilidades más frecuentes (obesidad, diabetes e hipertensión), y las complicaciones shock, insuficiencia renal aguda (IRA) y neumonía asociada a la ventilación mecánica (NAV), por un lado, y las alteraciones de parámetros clínicos y de laboratorio registrados.
Resultados: El 69% era varón. La incidencia de comorbilidades difirió para los diferentes grupos de edad. La mortalidad aumentó significativamente con la edad (p<0,00001). Las comorbilidades, hipertensión y diabetes, y las complicaciones de IRA y shock se asociaron significativamente con la mortalidad. En el análisis multivariado, sólo la edad mayor de 60 años, la IRA y el shock permanecieron asociados con la mortalidad.
Conclusiones: El SDRA en COVID-19 es más común entre los mayores. Solo la edad >60 años, el shock y la IRA se asociaron a la mortalidad en el análisis multivariado.
Palabras clave: COVID-19, distress respiratorio, complicaciones, comorbilidades, mortalidad, edad.
Abstract
Objectives: Millions of patients with COVID-19 were admitted to intensive care worldwide, half developed acute respiratory distress syndrome (ARDS) and received invasive mechanical ventilation (IMV), with a mortality of 50%. We analyzed how age, comorbidities and complications in patients with COVID-19 and ARDS who received IMV were associated with the risk of dying during their hospitalization.
Methods: Observational, retrospective and multicenter cohort study carried out in 5 hospitals (three private and two public university hospitals) in Argentina and Chile, during the second half of 2020.
Patients >18 years of age with SARS-CoV-2 infection confirmed by RT-PCR, who developed ARDS and were assisted with IMV for >48 hours, during the second half of 2020, were included. History, the most frequent comorbidities (obesity, diabetes and hypertension) and the complications of shock, acute renal failure (AKI) and pneumonia associated with mechanical ventilation (VAP), on the one hand, and the alterations of recorded clinical and laboratory parameters, were analyzed.
Results: 69% were men. The incidence of comorbidities differed for different age groups. Mortality increased significantly with age (p<0.00001). Comorbidities, hypertension and diabetes, and complications of ARF and shock were significantly associated with mortality. In the multivariate analysis, only age over 60 years, ARF and shock remained associated with mortality.
Conclusions: ARDS in COVID-19 is more common among the elderly. Only age >60 years, shock and ARF were associated with mortality in the multivariate analysis.
Keywords: COVID- 19, respiratory distress, complications, comorbidities, mortality, age.
Introducción
En diciembre de 2019 surgió un nuevo coronavirus llamado SARS-CoV-2, causante de la enfermedad COVID-19, la mayor pandemia que desbordó la capacidad de muchas unidades de cuidados intensivos (UCIs) y afectó y mató a un número de pacientes nunca visto en los últimos 100 años.1 Su presentación en los enfermos críticos es la de neumonía grave con variable de afectación sistémica. Dos de cada 10 pacientes con COVID-19 merecieron internarse, el 25% de ellos en UCIs debido a su condición crítica, incluida hipoxemia severa;2 la mayoría de estos requerían intubación y ventilación mecánica invasiva (VMI).3,4 Estos pacientes presentaban infiltrados pulmonares bilaterales de origen no cardiogénico e hipoxemia [relación presión parcial de oxígeno (PaO2) /fracción de oxígeno inspirado (FiO2) < 300 mmHg con una presión espiratoria final positiva (PEEP) > 5 cmH2O], cumpliendo la definición del síndrome de distrés respiratorio agudo (SDRA) de Berlín.5,6 Estos pacientes críticos tienden a ser mayores, tienen comorbilidades como hipertensión, diabetes mellitus y obesidad, y con frecuencia desarrollan complicaciones graves como shock, insuficiencia renal aguda (IRA) y neumonía asociada a VMI (NAVM).7 La combinación de envejecimiento, tipo, número y gravedad de las comorbilidades y/o complicaciones impactó en la presentación clínica y el resultado de esta enfermedad.
Pocos estudios han abordado específicamente el impacto en el resultado de la enfermedad de la interacción entre la edad, las comorbilidades y las complicaciones en pacientes críticos con COVID-19 que requieren VMI. Los datos disponibles durante el comienzo de la pandemia sugirieron una baja incidencia de infección nosocomial;8 sin embargo, la NAVM resultó más común en estos pacientes que en los ventilados mecánicamente con neumonía grave adquirida en la comunidad de diferente etiología.9
Nuestro objetivo fue analizar cómo la edad, las comorbilidades, las complicaciones y su combinación influyeron en los resultados de la COVID-19, y en los desenlaces, en particular en la mortalidad, en estos pacientes críticos en VMI con neumonía por SARS-CoV-2 y SDRA.
Métodos
Diseño y población del estudio
Estudio de cohorte retrospectivo y multicéntrico en 5 UCIs de hospitales públicos y privados de dos países (4 en Argentina y 1 en Chile), que reclutaron pacientes como parte de la población del estudio multinacional ECMOCARD (Extra-Corporeal Membrane Oxygenation for 2019 novel Coronavirus Acute Respiratory Disease) para la enfermedad respiratoria aguda COVID-19, realizado por la Universidad de Queensland, Australia. Se incluyeron todos los casos confirmados de COVID-19 mediante prueba de reacción en cadena de la polimerasas transcriptasa reversa (RT-PCR) en muestras de vías respiratorias superiores o inferiores, mayores de 18 años de edad, internados entre el 1 de junio y el 31 de diciembre de 2020, y que recibieron VMI durante > 48 horas, presentaron infiltrados pulmonares no cardiogénicos en la radiografía de tórax o tomografía computarizada e hipoxemia, con una PaO2/FiO2 < 300 mmHg, y con presión positiva de fin de espiración (PEEP) > 5 cm H2O. Se recogieron datos de los pacientes críticos consecutivos con COVID-19 ingresados en nuestras UCIs, en forma prospectiva.8
Los Comités de Ética y las Juntas de Revisión Institucional aprobaron el protocolo del estudio. Tratándose de una investigación que no implicaba riesgos para los pacientes y utilizando datos recogidos en la práctica diaria, una vez que los centros confirmaron una política de protección de datos personales, fueron liberados de obtener el consentimiento informado por parte de los Comités de Ética.
En la base de datos se registraron las características demográficas y clínicas, comorbilidades preexistentes, complicaciones ocurridas durante la estancia, y evidencias clínicas y de estudios complementarios que permitieron evaluar el curso de la enfermedad. Los resultados de las complicaciones (evolución de la presión arterial, creatinina sanguínea, uso de hemodiálisis, cultivos de secreciones respiratorias, etc.) se recogieron de los registros del formulario de reporte de caso del estudio ECMOCARD. Aunque la base de datos es muy extensa, a los fines de este manuscrito se evaluaron los puntajes de gravedad y otras medidas relativas a los cuidados respiratorios, además de la VMI, recibidos durante su estancia en las UCI, incluidos oxigenoterapia mediante bigotera nasal, mascarilla común o con reservorio o cánula nasal de alto flujo (CNAF), y el decúbito prono. Se registraron la posición, la ventilación no invasiva o la oxigenación por membrana extracorpórea (ECMO). También se registraron los datos clínicos recolectados respecto a: la ventilación mecánica (FiO2 , PEEP y PaO2/FiO2), el tiempo de estancia en la UCI y la mortalidad a 28 días de su ingreso a la UCI.
El diagnóstico de NAV se basó en la presencia de un infiltrado radiológico pulmonar nuevo o progresivo más al menos 2 de los criterios temperatura corporal (> 38,5ºC o < 36,5ºC); recuento de glóbulos blancos (> 12.000 o < 4.000 por mm3) y secreciones respiratorias purulentas9,10 más un cultivo cuantitativo del aspirado traqueal [> 105 unidades formadoras de colonias (UFC)/ml] o del lavado broncoalveolar cuantitativo (> 104 UFC/ml), presentes después de 48 horas de VMI.11,12
Análisis estadístico
Se planeó incluir, al menos, a 500 pacientes. Las variables cuantitativas se expresaron según su distribución, como medias ± desviación estándar o medianas con rango Inter cuartil [RIC] e intervalos de confianza [IC] del 95%; y variables categóricas en valores porcentuales. Se compararon variables continuas según distribución, se aplicó la prueba T a variables paramétricas y la prueba de Mann-Whitney a variables categóricas. Se utilizó χ2 para variables categóricas. Los días desde el ingreso a la UCI hasta el fallecimiento constituyeron el tiempo de análisis en los que fallecieron; el resto de los pacientes seguían vivos en la UCI, en el hospital fuera de la UCI o de alta. Para pacientes reingresados a la UCI después del alta, solo se consideró en el análisis el primer ingreso. En los que tuvieron más de un episodio de NAV, solo se consideró el primero.
La evaluación del impacto de las comorbilidades y complicaciones sobre la mortalidad se realizó mediante análisis univariado y por análisis multivariado de regresión logística, ajustando las variables, determinando los factores de confusión y aplicando la regresión logística múltiple.
Se estimó la incidencia acumulada de shock, IRA y NAV a 28 días, considerando la supervivencia a 28 días como un evento competitivo.
Se utilizó el software STATA 14.2 (StataCorp® Texas, EEUU).
Resultados
Se incluyeron 496 pacientes en los 5 centros participantes. Nueve pacientes fueron excluidos porque su PaO2/FiO2 mientras recibían VMI con PEEP ≥ 5 cmH2O era > 300 mmHg (el valor máximo considerado en la definición de Berlín) y 30 fueron excluidos debido a datos incompletos u otras inconsistencias. Las características demográficas, antecedentes, comorbilidades, tratamientos y complicaciones de los restantes 458 pacientes al ingreso a la UCI se muestran en la Tabla 1.
Tabla 1
Distribución por grupos de edad, sexo y principales comorbilidades en pacientes con COVID-19 y síndrome de dificultad respiratoria aguda en general y en cada uno de los sitios donde ingresaron a la UCI y fueron ventilados mecánicamente durante al menos 48 horas.
|
Todos |
Hospital Clínico, Universidad de Chile, Santiago |
Hospital Alemán de Buenos Aires |
Hospital de Comunidad, Mar del Plata |
Hospital Clínicas, Universidad de Buenos Aires |
Clínica Pasteur, Neuquén |
p |
|||||||
|
Media |
DS |
Media |
DS |
Media |
DS |
Media |
DS |
Media |
DS |
Media |
DS |
||
|
Edad |
62,5 |
13,9 |
53,1 |
13,2 |
70,7 |
11,7 |
63,9 |
11,9 |
65,6 |
13,9 |
61,3 |
12,6 |
<,0001 |
|
N |
% |
N |
% |
N |
% |
N |
% |
N |
% |
N |
% |
||
|
Todos |
458 |
100 |
92 |
20,1 |
83 |
18,1 |
35 |
7,6 |
107 |
23,4 |
141 |
30,8 |
|
|
Varones |
314 |
68,6 |
64 |
69,6 |
59 |
71,1 |
23 |
65,7 |
63 |
58,8 |
107 |
75,9 |
0,08 |
|
Grupo Etario |
|||||||||||||
|
18-49 |
79 |
17,2 |
34 |
37,0 |
4 |
4,8 |
5 |
14,3 |
15 |
14,0 |
21 |
14,9 |
<,0001 |
|
50-59 |
91 |
19,9 |
25 |
27,2 |
12 |
14,5 |
8 |
22,9 |
14 |
13,1 |
31 |
22,0 |
0,0528 |
|
60-69 |
131 |
28,6 |
22 |
23,9 |
15 |
18,1 |
7 |
20 |
33 |
30,8 |
54 |
38,3 |
0,0111 |
|
≥70 |
157 |
34,3 |
10 |
10,9 |
52 |
62,6 |
15 |
42,8 |
45 |
42,1 |
35 |
24,8 |
<,0001 |
|
Antecedentes |
|||||||||||||
|
Hipertensión |
206 |
44,1 |
26 |
27,9 |
41 |
49,4 |
17 |
48,6 |
57 |
49,6 |
65 |
46,1 |
0,1231 |
|
Diabetes |
131 |
28,0 |
27 |
29 |
18 |
21,7 |
13 |
37,1 |
27 |
27,5 |
46 |
32,6 |
0,0138 |
|
Obesidad |
128 |
27,4 |
23 |
24,7 |
11 |
13,2 |
13 |
37,1 |
29 |
25,2 |
52 |
36,8 |
0,0152 |
|
Fumador |
30 |
8,5 |
4 |
4,3 |
2 |
2,4 |
3 |
8,6 |
5 |
7,2 |
21 |
14,9 |
0,0024 |
|
EPOC |
20 |
5,7 |
1 |
1,1 |
10 |
12 |
4 |
11,4 |
2 |
3,5 |
5 |
3,5 |
<,0011 |
|
Asma |
12 |
3,4 |
3 |
3,2 |
4 |
4,8 |
0 |
0 |
3 |
3,3 |
5 |
3,5 |
0,8509 |
|
Neoplasia |
29 |
8,2 |
1 |
1,1 |
18 |
21,7 |
5 |
14,3 |
3 |
3,5 |
5 |
3,5 |
<,0001 |
|
Otra Enf. |
34 |
9,6 |
3 |
3,2 |
12 |
14,5 |
3 |
8,6 |
5 |
7,3 |
16 |
11,3 |
0,06 |
|
Otra |
110 |
31,9 |
18 |
19,3 |
14 |
18,4 |
6 |
17,1 |
2 |
15,1 |
72 |
51,1 |
<,0001 |
El porcentaje de varones fue 69% (314 de 458), sin diferencias significativas en la distribución por sexo entre los diferentes sitios (Tabla 1) (p=0,08). Sin embargo, la distribución de la mayoría de las comorbilidades (excepto diabetes mellitus, asma y enfermedad cardiovascular en general) fue diferente entre los diferentes sitios participantes. La representación de los grupos de edad también fue diferente entre los sitios con excepción del grupo de 50 a 59 años (Tabla 1).
Mortalidad
Comparando los grupos etarios, fue de 19,0% en pacientes de 18 a 49 años; 31,9% en pacientes de 50 a 59 años; 47,3% en pacientes de 60 a 69 años y de 78,3% en pacientes mayores de 69 años (p <0,00001) (Figura 1).
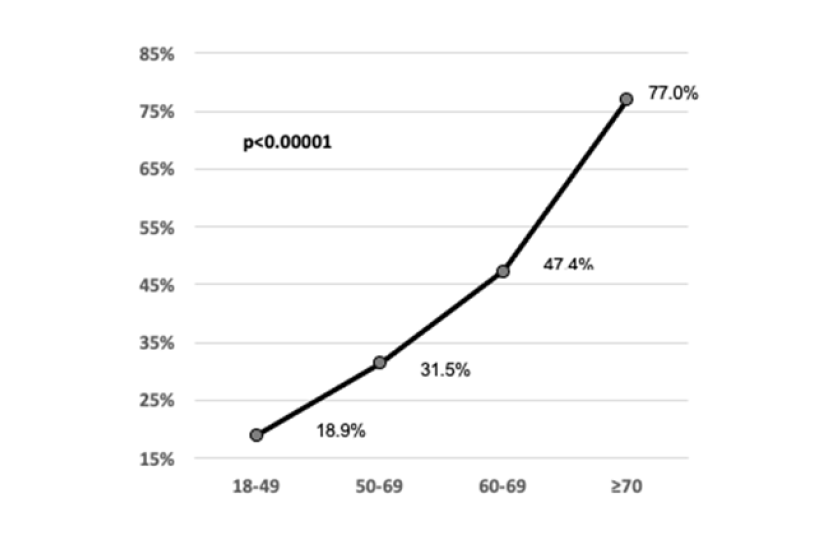
Figura 1.
Mortalidad por grupo etario. La figura muestra la fuerte correlación positiva encontrada entre la mortalidad y los años de edad para todos los grupos de edad. Se observa una alta coincidencia entre el aumento de la edad y el resultado fatal en pacientes críticamente enfermos
Las comorbilidades notificadas con mayor frecuencia fueron hipertensión (202 pacientes), diabetes mellitus (129 pacientes) y obesidad (126 pacientes). Otras comorbilidades frecuentes fueron otras enfermedades cardiovasculares, tabaquismo, neoplasia maligna, EPOC y asma (Tabla 1). La incidencia de hipertensión, diabetes y obesidad en los grupos de edad mencionados fue diferente. En el grupo 18-49 años la comorbilidad más frecuente fue obesidad (en 37,0%), en el grupo de 50-59 años fue diabetes (31,5%) y en los grupos de 60 a 69 y mayores de 69 años fue hipertensión (53,4 y 62,1%), respectivamente (Figuras 2A y 2B), p<0,05 para obesidad; y p;0,001 para diabetes e hipertensión.

Figura 2 A. (Izquierda)
Figura que muestra la incidencia porcentual de obesidad y diabetes mellitus a través de los diferentes grupos de edad. Mientras que la frecuencia de la obesidad disminuyó constantemente con la edad, la de la diabetes aumentó hasta el grupo de edad de 60 a 69 años y a partir de esa edad comenzó a disminuir.
Figura 2 B. (Derecha)
Se puede observar el aumento de la incidencia de hipertensión arterial a través de los distintos grupos de edades. En menores de 50 años, obesidad fue la comorbilidad más frecuente; en el grupo de 50 a 59 años, fue diabetes; y en los mayores de 60 años, fue hipertensión. Las diferencias para obesidad, diabetes e hipertensión fueron significativas (ver detalle en el texto).
En cuanto a las complicaciones, las más frecuentes en estos pacientes fueron shock (274 pacientes), IRA (235 pacientes) y NAVM (201 pacientes).
En los 201 episodios de NAVM, se aislaron 287 patógenos; 1,43 microorganismos por episodio (Tabla 2). Los aislados con mayor frecuencia fueron Klebsiella pneumoniae (N=70), Pseudomonas aeruginosa (N=46), Staphylococcus aureus (N=58) y Acinetobacter spp (N=39). La mayoría presentaron un patrón de pobre de susceptibilidad a los antimicrobianos, particularmente en las bacterias Gram-negativas, lo que produce en muchos casos ß-lactamasas o carbapenemasas de amplio espectro. Un análisis más profundo de estos patrones está lejos del alcance de este estudio. Respecto a la NAVM, no encontramos que la presencia de esta se asociara con la mortalidad ni en la población total, ni en ninguno de los grupos de edad.
En el análisis univariado, como se observa en la Tabla 3, se tuvieron en cuenta los diferentes grupos de edad de los mayores de 50 años, las comorbilidades, hipertensión y diabetes mellitus, la combinación de 2 comorbilidades (entre hipertensión, diabetes y obesidad) y las complicaciones shock e IRA, así como el uso de oxigenoterapia con cánula nasal de bajo y alto flujo, y de la posición prona con VMI, asociados significativamente con la mortalidad. En cuanto a las variables continuas evaluadas, sólo la edad y el menor tiempo de estancia en UCI se asociaron con mayor mortalidad. Ni la PaO2/ FiO2 al ingreso ni el tiempo de VMI se asociaron con la mortalidad (Tabla 1).
En el análisis multivariado, las categorías de edad entre 60 y 69 años y mayores de 69 años, y las complicaciones del shock y la IRA permanecieron relacionadas significativamente con la mortalidad (Tabla 4).
Tabla 2.
Uso de diferentes métodos de administración de oxígeno antes del uso de ventilación mecánica, días en ventilación mecánica y en la UCI, mediana o PaO2/FiO2 en general y en incidencia de neumonía asociada al ventilador, insuficiencia renal aguda, shock, SDRA y muerte en la UCI en general y en cada uno de los sitios donde ingresaron los diferentes pacientes.
|
Todos |
Hospital Clínico, Universidad de Chile, Santiago |
Hospital Alemán de Buenos Aires |
Hospital de Comunidad, Mar del Plata |
Hospital Clínicas, Universidad de Buenos Aires |
Clínica Pasteur, Neuquén |
||||||||
|
N |
% |
N |
% |
N |
% |
N |
% |
N |
% |
N |
% |
Valor de P |
|
|
Todos |
458 |
100 |
92 |
20,1 |
83 |
18,1 |
35 |
7,6 |
107 |
23,4 |
141 |
30,8 |
|
|
Oxígeno Bajo Flujo |
185 |
56,7 |
90 |
97,8 |
69 |
83,1 |
6 |
17,1 |
19 |
16,5 |
0 |
0 |
<,0001 |
|
Oxígeno Alto Flujo |
178 |
38,2 |
12 |
12,9 |
59 |
71,1 |
19 |
54,3 |
32 |
27,8 |
56 |
40 |
<,0001 |
|
Mediana |
IC 95 |
Mediana |
IC 95 |
Mediana |
IC 95 |
Mediana |
IC 95 |
Mediana |
IC 95 |
Mediana |
IC 95 |
||
|
Días en la UCI |
18 |
5-77 |
16 |
5-42 |
19 |
5-33 |
17 |
1-60 |
22 |
5-63 |
44 |
8-127 |
0,0528 |
|
PaO2/FiO2 |
102 |
60-254 |
132 |
60-280 |
159 |
110-216 |
137 |
64-265 |
146 |
62-302 |
120 |
56-206 |
0,0111 |
|
Complicaciones |
N |
% |
N |
% |
N |
% |
N |
% |
N |
% |
N |
% |
|
|
NAVM |
201 |
43,9 |
30 |
32,3 |
40 |
42,2 |
15 |
42,9 |
54 |
50,5 |
62 |
44,0 |
0,1231 |
|
Ins Renal Aguda |
235 |
51,3 |
40 |
43,5 |
63 |
75,9 |
15 |
42,9 |
63 |
58,9 |
54 |
58,3 |
<0,0001 |
|
Shock |
273 |
59,6 |
44 |
45,7 |
54 |
65,1 |
24 |
68,6 |
66 |
61,7 |
86 |
61,0 |
0,0001 |
|
SDRA leve |
52 |
11,3 |
12 |
13,0 |
15 |
18,1 |
4 |
11,4 |
11 |
10,3 |
10 |
7,1 |
0,1556 |
|
SDRA moderado |
257 |
53,9 |
38 |
41,3 |
64 |
77,1 |
19 |
54,3 |
56 |
52,3 |
80 |
56,7 |
0,0001 |
|
ARDS severo |
139 |
29,9 |
42 |
45,7 |
4 |
4,8 |
12 |
34,3 |
40 |
37,4 |
51 |
36,2 |
<,0001 |
|
Días n la UCI |
232 |
49,7 |
28 |
30,1 |
65 |
78,3 |
16 |
45,7 |
70 |
60,9 |
53 |
37,6 |
<,001 |
Tabla 3.
Factores asociados con mortalidad (análisis univariado)
|
Variables discretas |
|
OR |
IC95 |
p |
|
Grupos etarios |
18-49 |
Referencia |
|
|
|
|
50-59 |
1,8700- |
0,9269 -3,7729 |
0,08 |
|
|
60-69 |
3,6562- |
1,9198 - 6,9635 |
<0,001 |
|
|
>=70 |
13,6149- |
7,0454 - 26,3098 |
<0,001 |
|
Varones |
0,9600- |
0,6520 - 1,4199 |
0,846 |
|
|
Hipertensión |
2,4773- |
1,7026 - 3,6047 |
<0,001 |
|
|
Diabetes Mellitus |
1,5270- |
1,0163 - 2,2942 |
0,042 |
|
|
Obesidad |
0,82047- |
0,5458 - 1,2333 |
0,341 |
|
|
NAVM |
1,0593- |
0,7348 - 1,5271 |
0,757 |
|
|
SHOCK |
4,3553- |
2,7342 - 6,9375 |
<0,001 |
|
|
Insuficiencia Renal Aguda |
4,4729- |
3,0324 - 6,5978 |
<0,001 |
|
|
Oxígeno a Bajo Flujo |
0,49847- |
0,3179 - 0,7816 |
0,002 |
|
|
Oxígeno a Alto Flujo |
1,5365- |
1,0549 - 2,2381 |
0,025 |
|
|
Posición Prono Despierto |
1,0774- |
0,6114 - 1,8986 |
0,796 |
|
|
VMI + Decúbito Prono |
1,8593- |
1,2402 - 2,7874 |
0,003 |
|
|
Variables continuas |
OR |
IC95 |
p |
|
|
Edad |
1,0730- |
1,054916 - 1,0913 |
<0,001 |
|
|
Días en VM invasiva |
0,9900- |
0,984016 - 1,0000 |
0,13 |
|
|
Días en VM |
0,9700- |
0,9600 - 0,9800 |
<0,001 |
|
|
PaO2/FiO2 |
0,9981- |
0,995224 - 1,0011 |
0,211 |
|
|
2 comorbilidades * |
1,8980- |
1,248032 - 2,8864 |
0,003 |
|
|
Hipertensión + Diabetes |
2,2073- |
1,348724 - 3,6124 |
0,002 |
|
|
Hipertensión + Obesidad |
1,6148- |
0,929905 - 2,8041 |
0,089 |
|
|
Diabetes + Obesidad |
1,4973- |
0,807695 - 2,7757 |
0,2 |
|
|
3 Comorbilidades * |
|
1,8495- |
0,887912 - 3,8526 |
0,1 |
|
* Entre hipertensión, diabetes e obesidad |
||||
Tabla 4.
Factores asociados con mortalidad (análisis multivariado)
|
Variable |
|
OR |
IC 95 |
p |
|
|
Varones |
1,55 |
0,62 |
3,87 |
0,347 |
|
|
Grupo etario |
|
|
|||
|
|
18-49 |
Ref. |
|
||
|
|
50-59 |
1,91 |
0,56 |
6,58 |
0,303 |
|
|
60-69 |
6,42 |
1,84 |
22,38 |
0,004 |
|
|
>70 |
17,41 |
4,65 |
65,16 |
0,000 |
|
|
|
|
|||
|
Hipertensión |
1,16 |
0,45 |
3,02 |
0,758 |
|
|
Diabetes Mellitus |
1,66 |
0,62 |
4,47 |
0,314 |
|
|
Shock |
4,61 |
1,90 |
11,15 |
0,001 |
|
|
Ins. Renal Aguda |
6,47 |
2,28 |
18,34 |
0,000 |
|
|
Oxígeno a Bajo Flujo |
0,89 |
0,34 |
2,36 |
0,819 |
|
|
Oxígeno a Alto Flujo |
3,36 |
1,33 |
8,49 |
0,010 |
|
|
IMV + Prono |
0,53 |
0,19 |
1,47 |
0,222 |
|
|
Días en la UCI |
0,90 |
0,86 |
0,94 |
0,000 |
|
Discusión
Observamos en 458 pacientes críticos con COVID-19 que desarrollaron SDRA y requirieron VMI durante más de 48 horas seguidas hasta el alta o muerte por un máximo de 28 días, que eran mayores, frecuentemente tenían hipertensión, diabetes, obesidad y otras comorbilidades y sufrieron complicaciones como shock, IRA y NAVM. El objetivo principal fue determinar cómo la edad, las comorbilidades y las complicaciones se relacionaban con la mortalidad. En el análisis univariado encontramos que en pacientes con COVID-19 que desarrollan SDRA la edad ≧ 50 años, las comorbilidades hipertensión, diabetes y obesidad, y la complicación shock se asociaron significativamente con la mortalidad a los 28 días. Pero en el análisis multivariado, sólo la edad ≧ 60 años, el shock y la IRA continuaron significativamente asociados con la mortalidad.
El SDRA es una condición claramente asociada a la gravedad de la enfermedad de los pacientes en VMI con neumonía por COVID-19 y, en consecuencia, también asociada a la mortalidad. Se ha reconocido que la gravedad del SDRA según los criterios de Berlín se correlaciona con una mayor mortalidad. Sin embargo, Cilloniz et al. encontraron que la mortalidad en 125/432 pacientes con NAC grave tratados con VMI, que cumplían con los criterios de Berlín, no fue diferente de la encontrada en pacientes que no desarrollaron SDRA.13 Por otro lado, se ha afirmado que en estos pacientes la causa de muerte es más comúnmente sepsis e y falla multiorgánica que insuficiencia respiratoria.14 Otro estudio encontró que entre los pacientes de edad avanzada con COVID-19 y puntuaciones más altas de APACHE II al ingreso, aquellos que desarrollaron IRA (particularmente grado > II) y/o shock séptico durante la estancia en la UCI tenían un mayor riesgo de muerte.15
La gravedad de la presentación clínica y la alta mortalidad son dos patrones que se han encontrado consistentemente en pacientes con COVID-19 que ingresan en UCI y requieren VMI como parte de su soporte vital.13,16,17 Los pacientes que llegan a esta situación suelen presentar algunas características que los diferencian de aquellos con una enfermedad menos grave. Otros autores han observado que los pacientes críticos por COVID-19 son de mayor edad y portadores de diferentes comorbilidades, además suelen presentar complicaciones durante su estancia en la UCI, incluso antes de ser remitidos a estas áreas hospitalarias de alta complejidad, entre ellas, IRA y shock como condiciones para su ingreso en la UCI.16
Encontramos un aumento de la mortalidad asociado al uso de CNAF. Varios estudios publicados durante los últimos tres años mostraron que la CNAF no reduce la mortalidad comparada con la oxigenoterapia estándar.18-21
Chandel et al. en un estudio22 mostraron que los pacientes en los que falló la CNAF eran significativamente mayores (60 vs 54 años, p< 0,01), más graves (SOFA 4 vs 2, p< 0,01) y lucían más “inflamados” (razón neutrófilos/linfocitos 8,1 vs 6,1, p; 0,01). Nurok et al. compararon la probabilidad de extubación exitosa y mortalidad en 440 pacientes (311 recibieron CNAF) relacionada al uso previo de CNAF, y no encontraron diferencia. Además, observaron mayor riesgo de mortalidad hospitalaria ajustada a potenciales confundidores en comparación con los pacientes que usaron CNAF.23
Nuestra observación en el sentido de que aquellos que deben recibir VMI por insuficiencia respiratoria tienden a tener comorbilidades y complicaciones es consistente con lo descrito por otros en pacientes críticos con COVID-19.24 En este estudio, encontramos que sólo los mayores de 59 años que sufrieron IRA o shock tenían mayor riesgo de morir.
La edad de los pacientes con COVID-19 ingresados en UCI es superior a la de aquellos con presentación clínica menos grave, como ocurre en otras etiologías de NAC severa.25 Aunque muchos han reconocido a la NAVM en pacientes que reciben VMI como un factor significativamente asociado con una mayor mortalidad, la mortalidad a 28 días en pacientes críticos con COVID-19 parece ser mucho mayor que la observada en pacientes con NAVM asociada con la presencia de otras enfermedades subyacentes.26
Un aspecto a destacar en estos pacientes críticos con COVID-19, neumonía grave y que requieren VMI es el tiempo que suelen permanecer bajo ventilación mecánica durante su internación. Así, Serafim et al. observaron una mayor duración de la VMI en pacientes con COVID-19 de una mediana (RI) de 15 (9-23) días, en comparación con aquellos con otras neumonías virales de 10 (6-21) y con otras indicaciones de VMI de 8 (5-16) días. La mayor estancia en UCI de estos pacientes parece deberse a la presencia de complicaciones, en muchos casos atribuibles al estadio inflamatorio, como describen Wu et al.27
Encontramos una incidencia de al menos un episodio de NAVM de 56%, muy por encima de la incidencia observada en pacientes con neumonía bacteriana (26%) y otras neumonías virales (23%).28 Las posibles causas incluyen: duración prolongada de la VMI característica del COVID-19 crítico,29 sobrediagnóstico atribuible a la presencia de infiltrados extensos por el SDRA, que pueden confundirse con opacidades de neumonía, a hallazgos clínicos que también se superponen con los de neumonía,30 y al uso frecuente de corticoides en pacientes críticos con COVID-19.31 Por otro lado, los métodos de diagnóstico no invasivos (aspirado endotraqueal) usados muy frecuentemente en pacientes con COVID-19 podrían haber llevado a una sobre-identificación de bacterias. En un estudio, la identificación bacteriana utilizando aspirados traqueales ocurrió en el 86% de los pacientes, y utilizando métodos broncoscópicos distales cuantitativos en el 43%.32 Este hecho observado en pacientes críticos podría ser otra de las razones que justifican el uso de antibióticos empíricos. El uso de técnicas microbiológicas menos específicas reduce la especificidad del diagnóstico bacteriológico.8,9
La alta incidencia de NAVM no tuvo impacto en la mortalidad de estos pacientes. La ausencia de mortalidad atribuible está en línea con estudios recientes que describen una mortalidad atribuible limitada por NAV en COVID-19. Este hallazgo, que suena a paradoja, también ha sido encontrado por otros autores y podría deberse a diversas causas;33 en pacientes que estando en VMI suelen tener SDRA, y tratamientos antibióticos, en este contexto pueden inducir el desarrollo de multirresistencia.34 La paradoja de la elevada frecuencia de NAV no acompañada de una elevada mortalidad podría atribuirse al uso frecuente de métodos no broncoscópicos (sensibles y más disponibles en urgencias), menos específicos que el lavado broncoalveolar, para la obtención de muestras, lo que aumenta los resultados falsos positivos.35,36 Pero la pregunta de por qué la NAVM no aumentó la mortalidad en pacientes COVID-19 tratados con VMI sigue sin respuesta.26 Este estudio tiene varias limitaciones, entre ellas: la presencia de antecedentes y comorbilidades se investigó de forma prospectiva según los requisitos del protocolo ECMOCARD, que podría tener datos faltantes y potencialmente diferencias entre los diferentes sitios donde se reclutaron los pacientes. Por otro lado, no se pueden descartar los sesgos inherentes a los estudios retrospectivos y que el cálculo no se realizó para una potencia del estudio, por lo cual los resultados pueden incluir errores de tipo 1 o 2. Sin embargo, creemos que el hecho de que se trata de un estudio multicéntrico es a su vez uno de los puntos fuertes de nuestro estudio.
Conclusiones
La combinación de edad, comorbilidades y complicaciones fue útil para reconocer el riesgo de mortalidad de pacientes críticos con COVID-19 ingresados en UCI que recibieron VMI como método de soporte vital por más de 24 horas y desarrollaron SDRA, en una cohorte de pacientes ingresados en las UCIs de Argentina y Chile. La edad y algunas de las complicaciones que sufren estos pacientes podrían ser marcadores valiosos para el reconocimiento temprano de su riesgo de muerte, y así centrar su manejo en la prevención y el tratamiento de estas complicaciones.
Financiamiento: los autores declaran que el trabajo no tuvo financiamiento.
Conflictos de interés: los autores declaran que no tienen conflictos de intereses relacionados con el tema de esta publicación.
Contribuciones de los autores: conceptualización y diseño del estudio: CML. Registro de pacientes y manejo de bases de datos: FEA, GZ, FR, IZ, ME, JO, CML, CS, AV, DI. Análisis estadístico: IZ. Interpretación de resultados: FEA, GZ, ME, JO, CML. Borrador del manuscrito: FEA, GZ, ME, JO, IZ, CML. Revisión del manuscrito y aprobación de la versión final: todos los autores. CML es garante del manuscrito.
Reconocimiento: agradecemos a GL Li Bassi por su invitación a participar en el estudio ECMOCARD y por permitirnos utilizar los datos de pacientes que recopilamos en los 5 centros de Argentina y Chile que participan en este estudio recopilados por investigadores de ECMOCARD.
El Editor Adjunto, Dr. Rogelio Pérez Padilla, realizó el seguimiento del proceso de revisión y aprobó este artículo.
Referencias
2A. Obesidad, diabetes y grupo etario
OBESIDAD
DIABETES
[y/o]
2B. Hipertensión y grupo etario
[y/o]