

ARTÍCULO ORIGINAL | Respirar, 2023; 15(3): 188-199 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.15.3.5
Recibido:
9 agosto 2023
Aceptado:
31 agosto 2023
Elisa Barrera-Ramírez
https://orcid.org/0000-0002-2778-0882
Rubén Efraín Garrido-Cardona
https://orcid.org/0000-0001-6083-5403
Alejandro Martínez-Martínez
https://orcid.org/0000-0003-3448-910X
Luis Fernando Plenge-Tellechea
https://orcid.org/0000-0002-1619-5004
Edna Rico-Escobar
https://orcid.org/0000-0002-0933-0220
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
Descelularización y regeneración de tráquea porcina: un acercamiento a la ingeniería tisular
Decellularization and Regeneration of Porcine Trachea: an Approach to Tissue Engineering
Elisa Barrera-Ramírez1 , Rubén Efraín Garrido-Cardona2
, Rubén Efraín Garrido-Cardona2 , Alejandro Martínez-Martínez3
, Alejandro Martínez-Martínez3 , Luis Fernando Plenge-Tellechea3
, Luis Fernando Plenge-Tellechea3 ,Edna Rico-Escobar1
,Edna Rico-Escobar1
1 Universidad Autónoma de Ciudad Juárez, Instituto de Ciencias Biomédicas, Departamento de Ciencias de la Salud, Chih, México.
2 Centro Médico de Especialidades de Ciudad Juárez, Servicio de Cirugía de Tórax, México.
3 Universidad Autónoma de Ciudad Juárez, Instituto de Ciencias Biomédicas, Departamento de Ciencias Químicas, México.
Autor CORRESPONSAL:
Elisa Barrera Ramírez: ebarrera@uacj.mx
Resumen
Antecedentes: la ingeniería tisular permite obtener órganos como injertos a partir de tejidos descelularizados, regenerados con células autólogas.
Objetivo: descelularizar y regenerar tráqueas porcinas.
Material y métodos: se descelularizaron tráqueas porcinas colocándolas cada una en el epiplón de cuatro cerdos Yorkshire para su regeneración in vivo. Una tráquea descelularizada con tritón (DT), descelularizada con desoxicolato (DD), descelularizada con desoxicolato y reforzada con un polímero y células epiteliales (DDR), y una nativa criopreservada (NC). Después de 8 días se obtuvieron la DD, NC y DDR; y al día 15, la DT. Se las evaluó mecánica e histológicamente, se realizó el análisis casuístico.
Resultados: las tráqueas descelularizadas conservaron la integridad del cartílago, sin diferencias mecánicas, excepto la DDR con mayor rigidez. Las tráqueas regeneradas presentaron menor rigidez, excepto la DDR que además perdió el epitelio y la vascularidad. Las DT, DD mostraron epitelio no respiratorio, fibrosis y vasculogénesis con inflamación.
Conclusiones: las matrices conservaron sus características mecánicas. La regeneración in vivo ofrece ventajas como la esterilidad, interacción celular, nutrientes; es sencillo, factible y económico, pero no hay control del crecimiento celular y vascularización, y los tejidos presentaron alteraciones mecánicas e histológicas. El polímero impidió la re-epitelialización y revascularización. Este estudio abre la posibilidad de mejorar las metodologías de ingeniería tisular aplicadas al tejido traqueal.
Palabras clave: descelularización, regeneración, tráquea, ingeniería tisular.
Abstract
Introduction: tissue engineering makes it possible to obtain organs as grafts from decellularized tissues, regenerated with autologous cells.
Objective: decellularize and regenerate porcine tracheas.
Materials and Methods: Porcine tracheas were decellularized by placing each one in the omentum of four Yorkshire pigs for regeneration in vivo. A trachea decellularized with triton (DT), decellularized with deoxycholate (DD), decellularized with deoxycholate and reinforced with a polymer, and epithelial cells (DDR), and a cryopreserved native (NC). After 8 days, the DD, NC and DDR were obtained; and on day 15, the DT. The evaluation was mechanically and histologically, performing the case analysis.
Results: the decellularized tracheas preserved the integrity of the cartilage, with no mechanical differences, except for the DDR with greater rigidity. The regenerated tracheas presented less rigidity, except the DDR, which also lost the epithelium and vascularity. The DT, DD showed non-respiratory epithelium, fibrosis and vasculogenesis with inflammation.
Conclusions: the matrices retained their mechanical characteristics, in vivo regeneration offers advantages such as sterility, cell interaction, nutrients; it is simple, feasible and economical, but there is no control of cell growth and vascularization, and the tissues presented mechanical and histological alterations. The polymer prevented re-epithelialization and revascularization. This study opens the possibility of improving tissue engineering methodologies applied to tracheal tissue.
Key words: decellularized, regeneration, tracheas, tissue engineering.
Introducción
La ingeniería tisular permite la generación de órganos para sustituir funciones biológicas en trasplantes con ausencia de respuesta inmunológica. Los injertos traqueales pueden ser obtenidos por esta tecnología al descelularizar tráqueas de donadores y regenerar el tejido sembrando células del receptor.1-4 Para la regeneración es necesario un biorreactor que promueva el desarrollo del tejido y la angiogénesis.5-7
Cuando la estenosis traqueal no puede tratarse con resección y anastomosis término-terminal es necesario un trasplante o el uso de materiales sintéticos que no han tenido buenos resultados debido a la pérdida del epitelio y pobre vascularización.8-19 Para mejorar la vascularidad se ha intentado la anastomosis de la arteria tirotraqueal con la tiroidea y de forma indirecta colocar el injerto en los tejidos del receptor semanas antes de su implantación.20-23 El objetivo de este estudio consistió en descelularizar y regenerar tráqueas porcinas como un acercamiento a la ingeniería tisular.
La descelularización de la tráquea reduce la inmunogenicidad eliminando las células y, por lo tanto, las moléculas HLA. La matriz obtenida funciona como andamio que aporta una red de forma, tamaño y características mecánicas adecuadas para la regeneración del epitelio y vasos.24,25 Puede obtenerse de un donador de la misma especie (alogénica), de diferente especie (xenogénica), sintéticas (inorgánicas) o combinadas (híbridas).26-30
Las matrices híbridas buscan fortalecer la matriz ya que durante la descelularización se afectan las características mecánicas. Se han utilizado biopolímeros de polie-caprolactona (C6H10O2), poliéster alifático biodegradable, que se degrada en 2 a 4 años.7,31
La seguridad microbiológica y la esterilización de los órganos es un requisito que evita el daño tisular, debe ser biocompatible y accesible. Se han utilizado agentes físicos como la radiación (gamma, UV), calor húmedo, seco, gases (óxido de etileno) y químicos (timerosal, antibióticos, anti-fúngicos).32-34
Para mantener la integridad de tejidos es necesaria la criopreservación en condiciones óptimas de seguridad, temperatura y tiempo.35,36
La regeneración consiste en reconstruir los tejidos sembrando las células autólogas (progenitoras endoteliales, células madre, condrocitos costales, células epiteliales respiratorias) en un andamio hasta convertirse en células especializadas y lograr la revascularización, con la aportación de factores de crecimiento, nutrientes, en biorreactores naturales o mecánicos.37-41 Los inconvenientes son los largos periodos de siembra, alto costo, los riesgos de inestabilidad en la diferenciación celular y la contaminación.42
El cuerpo como biorreactor natural puede ser un dispositivo para cultivar tejidos (in vivo), requiere de cortos periodos de estancia, con menos riesgos de contaminación, a bajo costo, con los inconvenientes en el control de factores de crecimiento y diferenciación celular. 29,43,44
Material y métodos
Se cumplió con la Norma Oficial Mexicana NOM-062-ZOO-1999 para el cuidado de los animales y con la aprobación del Comité de Bioética del Instituto de Ciencias Biomédicas de la Universidad Autónoma de Ciudad Juárez (CBE.ICB/009.04-14).
Se obtuvieron cuatro tráqueas de cerdos donadores, se retiraron tejidos y se lavaron seis veces con tampón fosfato salino (PBS) y antibiótico (moxifloxacino, Bayer Sol 400 mg/250 mL i.v. lote BXG8Z21 oct 2015); en esta solución se almacenaron a 4oC hasta la descelularización.
La descelularización en una de las tráqueas se realizó con 0,05% de hidróxido amónico-tritón X-100 al 0,5%, descongelando a temperatura ambiente en agitación durante 72 horas a 4ºC a una velocidad entre 95 y 150 r.p.m., lavando 10 veces con agua destilada y almacenando a 4ºC en PBS 250 ml y moxifloxacino 10 ml hasta su esterilización (DT).45 Una tráquea se mantuvo en criopreservación a -80oC sin procesar (NC).1
A dos tráqueas se les aplicaron 8 y 17 ciclos de la descelularización cada 48 por 4 horas con 4% de desoxicolato sódico (sigma lot 61K0110) en NaCl 1mmol⁄L, 4 horas en agitación a temperatura ambiente, lavando con agua destilada agitando por 5 min, repitiendo el proceso 7 veces dejando en PBS y antibiótico a 4°C por 48 horas hasta el siguiente ciclo.1,30 Al finalizar los 8 y 17 ciclos, respectivamente, se procedió́ a continuar con la esterilización (DD).
La esterilización con rayos UV se realizó en todas las matrices DT, DD, NC después de lo cual se almacenaron a -80°C hasta su utilización.36,46
La matriz con 17 ciclos se reforzó (DDR) con un polímero de policaprolactona (PCL) de alto peso molecular, más partículas de colágeno tipo V de 20 µm de tamaño (método castin film) más solvente orgánico con multicapas de spray simple hasta que secó y se almacenó a 4°C.47 Se colocaron en esta matriz células epiteliales antes de su regeneración del cerdo que funcionaría como biorreactor, se colocaron en quirófano en decúbito supino y bajo anestesia general, 5 ml de propofol i.v. (200 mg/ml, Recofol PiSA Lot No 14276041 Cad 04-07-2016), se aplicó antiséptico local, solución de superóxido (Microdacyn, More Pharma) y se tomó una muestra de la mucosa nasal colocándola en un tubo de 5 ml con un 1 ml de tripsina para la disgregación enzimática (Trypsin 0,5% -EDTA 5,2 mM GIBCO BRL Cat No 15400-054, Lot No. 17K7171). Se dejó en agitación por 10 minutos a temperatura ambiente. En condiciones estériles en campana de flujo laminar, se neutralizó con 1 ml de medio de cultivo DMEM (Dulbeco´s Modified Eagle Medium 1x low glucose, with low L-glutamine, 110 mg/L sodium pyruvate, pyridoxine hydrochloride Cat No. 11885-084 Lot No. 1278668) con penicilina y estreptomicina centrifugando a 2500 r.p.m por 5 minutos, decantando y el botón se resuspendió en 2 ml de solución fisiológica y se trasladó a temperatura ambiente al quirófano para su implantación en la tráquea DDR. Se tomó una jeringa estéril de 3 ml, se aspiró el contenido de las células y se aplicó todo su contenido en la porción interna de la matriz. La matriz DDR se implantó en el epiplón abdominal del cerdo para su regeneración.
Fueron evaluadas las características mecánicas de todas las matrices antes de su implantación en el epiplón para su regeneración, con pruebas manuales de acuerdo a nuestro modelo; posteriormente se tomaron muestras para su análisis histológico.
Los parámetros evaluados fueron la rigidez (respuesta del tejido a la presión), flexibilidad (llegando a su límite al flexionarla) y conformación (capacidad de recuperación a su forma original después de la compresión).40
Se colocó cada matriz en el epiplón de la cavidad abdominal de cuatro cerdos Yorkshire para su regeneración in vivo. Fueron seleccionados cuatro cerdos Yorkshire sanos, tres machos y una hembra con pesos entre 23 y 33 kilogramos, con edad entre 4 y 5 meses (Tabla 1).
Los cerdos para recibir una matriz diferente en eventos quirúrgicos independientes se asignaron al azar (Tabla 1). Los animales recibieron clorohidrato de ketamina 3,5 mg/kg (Anesket, PiSA), clorohidrato de xilacina a 5 mg/kg (Rompun, Bayer) i.m. y fueron canalizados con solución Hartman (500 mL). Se anestesiaron con propofol 1,9 mg/kg (Recofol 200 mg/20 mL PiSA), se inició la cirugía con asepsia y antisepsia, con incisión abdominal hasta llegar a la cavidad abdominal, exponiendo el epiplón y envolviendo la matriz o en su caso la tráquea nativa criopreservada, fijándolas con puntos a la pared, cerrando posteriormente por planos. Se mantuvieron en observación hasta su recuperación de la anestesia y recibiendo antibiótico, 1,5 mL de moxifloxacino intramuscular (Avelox sol 400 mg amp 250 mL, Bayer, lot BX68221 oct 2015) 10 mg de prednisona cada 12 horas vía oral (Meticorten tab 5 mg, Schering-Plough), analgésico carprofeno 5% 1,2 mL intramuscular cada 24 horas por dos días (Centrovet, 100 mL/5 g, Ehlinger) y caprofeno vía oral 1 tab. cada 24 horas (Carprobay 50 mg Bayer) hasta su siguiente procedimiento; fueron examinados diariamente registrando datos de inflamación o infección, se aplicó moxifloxcino intramuscular cada 24 horas (400 mg amp 250 mL, Bayer lot BX68221 oct 2015).29
Tabla 1.
Animales de experimentación. Biorreactores naturales
|
Tráqueas |
Animales |
Sexo |
Peso |
Edad |
|
DT |
Cerdo Yorkshire |
M |
23.8 kg |
4 meses |
|
DD |
Cerdo Yorkshire |
M |
35 kg |
5 meses |
|
DDR |
Cerdo Yorkshire |
M |
33.8 kg |
4 meses |
|
NC |
Cerdo Yorkshire |
H |
31.2 kg |
4 meses |
Cerdos Yorkshire como biorreactores, cada uno recibió diferente matriz. La DT se colocó en un cerdo masculino de 23,8 kg de peso y de 4 meses de edad. La matriz DD se colocó en un cerdo masculino de 35 kg, de 5 meses de edad. En la DDR se utilizó un cerdo masculino de 33,8 kg de 4 meses y la NC se implantó en una hembra de 31,2 kg de 4 meses. M: Macho y H: Hembra.
La matriz descelularizada con tritón (DT) permaneció 15 días y las otras 8 días. Se procedió a obtener quirúrgicamente los tejidos regenerados para realizar la evaluación mecánica e histológica.
El análisis histológico macróscopico y microscópico de las matrices se llevó a cabo antes y después del proceso de regeneración, tomando como control una tráquea nativa fresca obtenida de un cerdo donador sano sacrificado con otro propósito. Las muestras de los tejidos se embebieron en parafina para realizar cortes de 5 m, se fijaron y tiñeron con eosina y hematoxilina. Por microscopía óptica (Microscopio Leica DM 2000 lámpara Mycrosystems tipo 11307072057/BZ:12 Hg100w procesador Leica application suite V3.1.0) se evaluaron las características estructurales como la presencia del epitelio, submucosa, cartílago, fibrosis, vasos sanguíneos, inflamación, con relación al control.40
Se realizó un análisis casuístico que consistió en registrar y recopilar los datos de las variables de los distintos casos con el propósito de formar un criterio sobre casos análogos y que serían los esperados en el mismo contexto.48
Resultados
Todos los animales sobrevivieron al experimento y no presentaron datos de inflamación o infección.4
Se evaluaron las diferencias en las características mecánicas e histológicas de las matrices y de los tejidos regenerados, en relación con los diferentes procedimientos para su obtención.
Las matrices DT, DD, NC no mostraron diferencias significativas en la evaluación de las propiedades mecánicas, como la capacidad de rigidez, flexibilidad y conformación con relación al control excepto la matriz DDR. La tráquea control recuperó su forma en un 100%, la tráquea descelularizada con tritón un 75%, la descelularizada con desoxicolato 8 ciclos un 80% y con 17 ciclos un 75%, la reforzada no tuvo esta capacidad 0% y la nativa criopreservada tuvo un 100% (Tabla 2).
Tabla 2.
Evaluación de las propiedades mecánicas de las matrices.
|
Matriz |
Rigidez |
Flexibilidad |
Conformación |
|
Tráquea Nativa (N) |
80% |
22% |
100% |
|
Descelularizada Tritón (DT) |
60% |
33% |
75% |
|
Descelularizada Desoxicolato 8 ciclos (DD) |
70% |
33% |
80% |
|
Descelularizada Desoxicolato 17 ciclos (DD) |
60% |
38% |
75% |
|
Descelularizada Reforzada 17 ciclos (DDR) |
100% |
0% |
0% |
|
Nativa Criopreservada (NC) |
75% |
27% |
100% |
Las propiedades mecánicas de rigidez, flexión y conformación de la tráquea nativa control N, en relación con la matriz DT la cual mostró disminución en su rigidez y conformación y aumentó su flexibilidad, al igual que la DD, y la descelularizada con desoxicolato 17 ciclos, la NC presentó características similares. La DDR aumentó su rigidez a un 100%, pero disminuyó drásticamente su flexión y conformación.
La evaluación histológica macróscopica de las matrices se hizo utilizando una tráquea nativa fresca y limpia como control, la cual presentó una superficie rosada con la luz intacta y vasos sanguíneos en la fascia externa. Las matrices DT y DD mostraron una superficie blanca traslúcida, con la luz sin cambios, sin falta de continuidad del cartílago y sin vasos sanguíneos en la fascia externa. La NC tenía un color rosado tenue y traslúcida con la luz traqueal normal y presencia de pocos vasos en la fascia externa. La DDR presentó una superficie externa blanca brillante, rígida con la luz sin anomalidad, sin vasos sanguíneos externos (Figura 1).
Figura 1.
Características histológicas macroscópicas de las matrices

La fotografía (A) Tráquea nativa control N, (B) Tráquea descelularizada con tritón DT, (C) Tráquea descelularizada con desoxicolato DD, (D) Tráquea nativa criopreservada NC, (E) Tráquea descelularizada con desoxicolato y reforzada con polímero DDR.
La evaluación histológica microscópica de las matrices mostró que la DT y DD no presentaron epitelio, ni glándulas y no se encontraron vasos sanguíneos, el cartílago se conservó, manteniendo condrocitos residuales con algunas fibras musculares sin células viables. La NC preservó el epitelio y la submucosa, así como los condrocitos y fibras musculares estructuralmente íntegros. La DDR no mostró evidencia de epitelio ni submucosa y el cartílago con pérdida de condrocitos, sin presencia de fibras musculares, el polímero recubría la superficie externa de la matriz (Tabla 3). La evaluación mecánica de las matrices regeneradas mostró que la DT se deformaba fácilmente a la presión mecánica en comparación con la DD, y la flexibilidad fue mucho mayor que el control. La NC perdió rigidez, aumentó su flexibilidad y disminuyó su conformación. La matriz DDR conservó su rigidez con incapacidad de regresar a su forma después de la presión.
Tabla 3.
Evaluación de las características histológicas microscópicas de las matrices
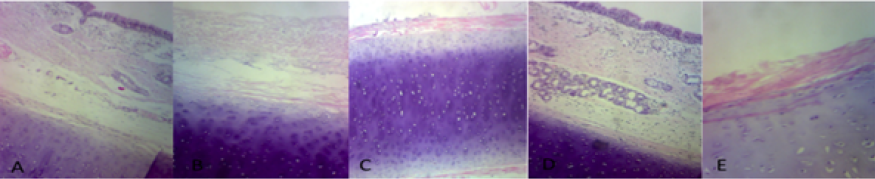
|
Matriz |
Epitelio |
Submucosa (Glándulas) |
Cartílago |
Vasos sanguíneos |
Tejido |
Reparación |
Tejido Adiposo |
Infiltrado Inflamatorio |
|
N (A) |
+ |
+++++ |
+++++ |
+++++ |
– |
– |
– |
|
|
DT (B) |
– |
– |
+++ |
– |
– |
– |
– |
|
|
DD (C) |
– |
– |
++++ |
– |
– |
– |
– |
|
|
NC (D) |
+ |
+++++ |
+++++ |
++++ |
– |
– |
– |
|
|
DDR (E) |
– |
– |
+++ |
– |
– |
– |
– |
Las características histológicas en la imagen (A) la tráquea nativa como control (N) a objetivo 10x, y en tabla con su estructura sin alteraciones, en la imagen (B) la tráquea DT con objetivo 10x y las diferencia en su estructura, la imagen (C) tráquea DD, objetivo 10x y la imagen (D) es la tráquea nativa criopreservada (NC) con objetivo 10x, la fotografía (E) tráquea DDR en objetivo 40x.
La flexibilidad de una tráquea nativa como su capacidad de formar un ángulo 140º sin lesionar el tejido es equivalente al 22%, la matriz descelularizada DT regenerada alcanzó un ángulo de 30º o 83% aumentando su flexibilidad 110º. La DD se flexionó 50º aumentando su flexibilidad 90º o 73%. La DDR no se flexionó permaneciendo en posición de 180º o 0% y la NC alcanzó un ángulo de 90º aumentando su flexibilidad 50º o 50%.
La conformación es del 100% en la tráquea nativa control, como la capacidad del tejido de volver a su forma original después de la compresión manual. La DT regenerada volvió a su conformación en un 25%, la DD regenerada un 50%, la DDR no recuperó su forma 0% y la nativa criopreservada presentó una conformación del 75%. (Tabla 4).
Tabla 4.
Evaluación de las propiedades mecánicas de las matrices regeneradas.
|
Tráquea |
Tiempo de regeneración |
Rigidez |
Flexibilidad |
Conformación |
|
Nativa (N) |
0 |
80% |
22% |
100% |
|
Descelularizada Tritón (DT) |
15 días |
25% |
83% |
25% |
|
Descelularizada Desoxicolato (DD) |
8 días |
30% |
73% |
50% |
|
Descelularizada Reforzada (DDR) |
8 días |
100% |
0% |
0% |
|
Nativa Criopreservada (NC) |
8 días |
50% |
50% |
75% |
Comparación de las propiedades mecánicas de las matrices regeneradas en relación con el tiempo que permanecieron en el epiplón del cerdo como biorreactor. La tráquea nativa (N) no fue sometida a este proceso mostrando sus características normales como control. La tráquea DT con un tiempo de regeneración de 15 días disminuyó su rigidez mostrando a la presión una luz del 25%, la DD fue del 30% permaneciendo ocho días, la reforzada (DDR) se encontró muy rígida con una luz del 100% y su permanencia en el biorreactor fue de 8 días al igual que la tráquea nativa criopreservada (NC) la cual también disminuyó su rigidez con un lumen a la presión del 50%.
A la evaluación macroscópica de las matrices regeneradas, la DT y DD mostraron evidencias de revascularización en la superficie externa y neoformación de tejido bien integrado en la superficie externa e interna, no mostraron datos de necrosis o infección. La DT presentaba mejor definición de los anillos traqueales que las DD, NC y DDR. En la NC se observó tejido inflamatorio superficial con neoformación de tejido y vasos bien integrados a su superficie. Todas conservaron la luz con reducción en su diámetro ya que el espesor total de la pared era mayor al de una tráquea nativa. En la DDR mostró tejido inflamatorio en la superficie externa y mayormente en la interna que obliteraba la luz en sus extremos (Figura 2). Se observaron diferentes características macroscópicas de la tráquea nativa fresca como control y la matriz DT antes y después de la regeneración (Figura 3), las diferencias con la matriz DD (Figura 4), la DDR (Figura 5), la NC antes y después de la regeneración (Figura 6).
Figura 2.
Características histológicas macroscópicas de las matrices regeneradas
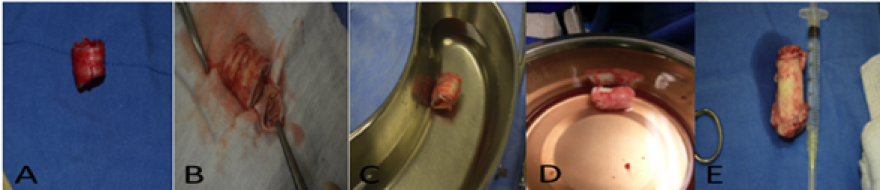
Las imágenes muestran los tejidos regenerados, (A) Tráquea nativa control N, (B) Tráquea descelularizada con tritón DT, (C) Tráquea regenerada descelularizada con desoxicolato DD, (D) Tráquea nativa criopreservada NC, (E) Tráquea descelularizada con desoxicolato reforzada con polímero y regenerada DDR.
Figura 3.
Características macroscópicas de la tráquea control, descelularizada con tritón y regenerada
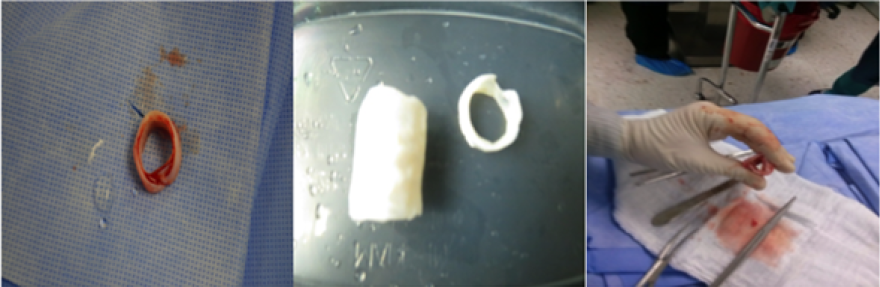
Las imágenes muestran, (A) Tráquea nativa como control N, (B) Tráquea descelularizada con tritón DT, (C) Tráquea DT regenerada en el biorreactor natural.
Figura 4.
Características macroscópicas de la tráquea control, descelularizada con desoxicolato 8 ciclos y regenerada
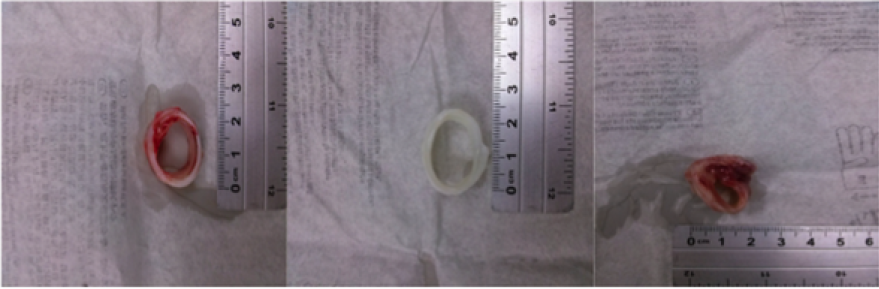
La imagen (A) Tráquea nativa como control N, (B) Tráquea descelularizada con desoxicolato DD, (C) Tráquea DD regenerada en el biorreactor natural.
Figura 5.
Características macroscópicas de la tráquea control, descelularizada con desoxicolato 17 ciclos reforzada con polímero y regenerada

La imagen (A) Tráquea nativa como control N, (B) Tráquea descelularizada con desoxicolato reforzada con polímero DDR, (C) Tráquea DDR regenerada en el biorreactor natural.
Figura 6.
Características macroscópicas de la tráquea control, tráquea nativa criopreservada y regenerada

La imagen (A) Tráquea nativa como control, (B) Tráquea nativa criopreservada NC, (C) Tráquea NC regenerada en el biorreactor natural.
En la evaluación histológica microscópica de las matrices regeneradas, la tráquea control presentó una arquitectura normal con un epitelio cilíndrico ciliado pseudoestratificado, submucosa, cartílago y capa muscular íntegros. La DT regenerada presentó epitelio no respiratorio en la parte central con generación de membrana basal y tejido conectivo laxo, en lugar de la submucosa fibrosis y proliferación de fibroblastos con vasculogénesis (+), el cartílago con pérdida de condrocitos, la neoformación incluyó tejido de reparación (++), tejido adiposo en la porción interna y externa (++) e infiltrado inflamatorio (+). La DD presentó epitelio células alargadas y tejido conectivo laxo en lugar de la submucosa tejido fibrótico, con vasculogénesis (++), el cartílago conservado con tejido de reparación (++), tejido adiposo en la porción interna (++) e infiltrado inflamatorio (++). La NC regenerada no presentó epitelio, con glándulas en la submucosa, fibrosis y vasculogénesis (++), el cartílago con pérdida de la matriz, tejido de reparación (+++) y tejido adiposo en la porción interna (+++) con infiltrado inflamatorio (+++).
En la DDR regenerada no se observó epitelio ni submucosa con fibrosis, vasculogénesis (++) y cartílago perdido, el tejido de reparación (+), tejido adiposo en la porción interna (+++), infiltrado inflamatorio (+++++) con células gigantes multinucleares delimitando el polímero que se encontró desprendido en ciertas zonas (Tabla 5).
Tabla 5.
Evaluación de las características microscópicas de las matrices regeneradas.
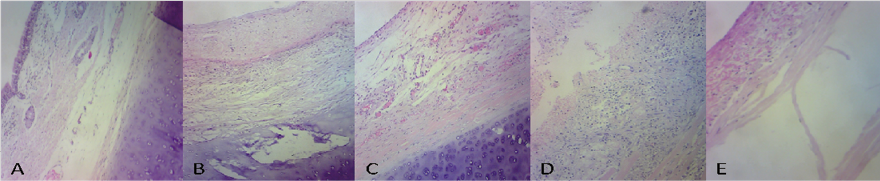
|
Matriz |
Tiempo Regeneración |
Epitelio |
Submucosa (glándulas) |
Cartílago |
Vasos |
Tejido Reparación (fibrosis) |
Tejido Adiposo |
Infiltrado |
|
N (A) |
0 |
+ |
+++++ |
+++++ |
+++++ |
– |
– |
– |
|
DT (B) |
15 días |
+ |
– |
+++ |
+ |
++ |
++ |
+ |
|
DD (C) |
8 días |
+ |
– |
++++ |
++ |
++ |
++ |
++ |
|
NC (D) |
8 días |
– |
+++ |
++ |
++ |
+++ |
+++ |
+++ |
|
DDR (E) |
8 días |
– |
– |
– |
++ |
+ |
+++ |
+++++ |
Las características histológicas de las matrices regeneradas, en la imagen (A) la tráquea nativa como control (N) a objetivo10 x, y en tabla con su estructura sin alteraciones, en la imagen (B) la tráquea DT con objetivo 10x y las diferencia en su estructura, la imagen (C) tráquea DD objetivo 10x, y la imagen (D) es la tráquea nativa criopreservada (NC) con objetivo 10x, la fotografía (E) tráquea DDR reforzada con polímero y células epiteliales en objetivo 40x.
En la evaluación mecánica comparativa antes y después de la regeneración, mostró que la tráquea control (N) presentó una rigidez del 80%. La matriz DT de un 60% después de la regeneración disminuyó a ٢٥٪. La DD antes de la regeneración ٧٠٪ y después ٣٠٪. La DDR antes y después de la regeneración fue del ١٠٠٪. Antes del proceso de regeneración, la NC mostró una rigidez del ٧٥٪ y después un ٥٠٪.
La propiedad de flexión del control fue del 22%. La DT con una flexibilidad del 33% aumentó en la regeneración a 83%. La DD antes del proceso de regeneración se flexionaba en un 33% y después llegaba a un 73%. La DDR no presentó flexibilidad antes y después con un 0%. La NC presentó un 27% y regenerada se incrementó a un 50%. En la conformación, la tráquea control con un 100% de capacidad de volver a su forma original, la DT volvía a su forma en un 75% y regenerada el 25%, la DD como matriz permitía una conformación del 80% y después de la regeneración disminuyó a 50%, DDR antes y después del proceso de regeneración perdió esta capacidad con un 0%. La NC de un 100% después del tratamiento de regeneración llegó a 75% (Tabla 6).
Tabla 6.
Evaluación mecánica comparativa de las matrices en relación con el tejido regenerado y el control.
|
Tráquea |
Rigidez |
Flexibilidad |
Conformación |
|||
|
Matriz |
Regenerada |
Matriz |
Regenerada |
Matriz |
Regenerada |
|
|
Nativa Control (N) |
80% |
22% |
100% |
|||
|
Descelularizada |
60% |
25% |
33% |
83% |
75% |
25% |
|
Descelularizada Desoxicolato (DD) |
70% |
30% |
33% |
73% |
80% |
50% |
|
Descelularizada Reforzada (DDR) |
100% |
100% |
0% |
0% |
0% |
0% |
|
Nativa |
75% |
50% |
27% |
50% |
100% |
75% |
La tráquea nativa control (N) muestra valores normales de rigidez, flexibilidad y conformación. La DT disminuyó su rigidez de 60% a 25% y su conformación de 75% a 25%, y aumentó su flexibilidad de 33% a 83%. La DD decreció su rigidez de 70% a 30%, y su conformación de 80% a 50% y aumentó su flexibilidad de 33% a 73%. La DDR inició y terminó con una rigidez del 100% con nula capacidad de flexión y conformación (0%). La nativa criopreservada (NC) con rigidez del 75% pasó a 50% y aumentó su flexibilidad de 27% a 50% con pérdida en la conformación de 100% a 75%.
Discusión
Los métodos de descelularización resultaron eficientes y las matrices obtenidas no mostraron cambios significativos en cuanto a sus características mecánicas, sin embargo, el método con tritón demostró ser más rápido y sencillo al conservar con mayor definición los anillos traqueales.1 Estas matrices podrían ser una opción como reemplazos traqueales no inmunogénicos, en lugar de otros materiales utilizados en la actualidad.28
El tejido regenerado no cumplió con los requisitos mecánicos de rigidez, flexibilidad, conformación de un injerto.3 Los tejidos que fueron regenerados presentaban neoformación, integración y vascularización independientemente del tiempo que permanecieron en el biorreactor 15 u 8 días, sin embargo, no se logró la regeneración del epitelio cilíndrico ciliado esencial en la función del tejido traqueal. Sería conveniente reducir el tiempo de regeneración de la matriz DT a 8 días para determinar si es un factor determinante en las características mecánicas del tejido neoformado o utilizar un material para reforzar el tejido, materiales que no induzcan un proceso inflamatorio tan potente. La tráquea NC generó un proceso inflamatorio ya que conservó su inmunogenicidad a pesar de la criopreservación. Algunos autores reportan que bajo ciertas condiciones de congelación de los injertos traqueales, mejoran su permanencia después del trasplante.49 En el biorreactor natural se deben utilizar líneas celulares y factores de crecimiento adecuados para lograr la diferenciación específica de ese epitelio no respiratorio al cilíndrico ciliado, y la neoformación del tejido de acuerdo a la estructura traqueal. A pesar de que la vasculogénesis no fue adecuada, todo indica que fue suficiente ya que no hubo zonas de necrosis. La regeneración in vivo utilizando el epiplón abdominal del cerdo puede ser una alternativa para la revitalización de las matrices o injertos nativos, mantiene las condiciones de esterilidad, permite la interacción celular y, por estar muy vascularizado, provee nutrientes y factores de crecimiento. Es un procedimiento sencillo, factible, económico y posiblemente proporcionará en un futuro un modelo para evaluar la repoblación y la regeneración funcional.
Conclusiones
Actualmente, existen múltiples técnicas en ingeniería de tejidos que han sido utilizadas con éxito, pero es necesario perfeccionarlas y seguir con el desarrollo de nuevos materiales y dispositivos para mejorar las características mecánicas del tejido regenerado incorporando fuerzas de cizallamiento. Los biorreactores actuales facilitan el crecimiento al permitir la visualización del tejido, la esterilización y el sembrado de diversos tipos de células en diferentes zonas del tejido.50,51 Es posible utilizar un reforzamiento con materiales biocompatibles que den la rigidez necesaria, la flexibilidad y conformación traqueal, sin ser tóxicos o inmunogénicos y que permitan la adecuada neoformación del tejido como del epitelio cilíndrico ciliado por auto ensamble celular, así como la vascularización incorporando los factores de crecimiento específicos durante el proceso de regeneración.52-54
Este trabajo es un acercamiento para mejorar las metodologías de ingeniería tisular y continuar explorando la capacidad de generar tejidos no inmunogénicos, útiles como injertos para su aplicación clínica.
Agradecimientos: al Dr. Enrique Vanegas Venegas por su aportación en los estudios histopatológicos, al Dr. Alfredo Hernández responsable de la Unidad de Cirugía Experimental de la Universidad Autónoma de Ciudad Juárez, y al Colegio de Chihuahua por su apoyo para la realización de este proyecto.
Financiamiento: los autores declaran que el trabajo no tuvo financiamiento.
Conflictos de interés: los autores declaran que no tienen conflictos de intereses relacionados con el tema de esta publicación.
Contribuciones de los autores: EBR: administración del proyecto, investigación, adquisición de fondos, análisis formal, escritura, redacción, borrador original. REGC: investigación, adquisición de fondos, metodología, recursos, supervisión. AMM: investigación, escritura-revisión, metodología, análisis formal, validación, visualización. LFPT: investigación, escritura-revisión, recursos. ERE: investigación, escritura-revisión.
Los autores declaran que NO han utilizado inteligencia artificial en la elaboración de la investigación y/o redacción del manuscrito.
El Editor en Jefe, Dr. Carlos Luna, realizó el seguimiento del proceso de revisión y aprobó este artículo.
Referencias