

CASO CLÍNICO | Respirar, 2023; 15(3): 217-221 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.15.3.8
Recibido:
20 mayo 2023
Aceptado:
25 agosto 2023
Luis Eduardo Ramírez Bejarano
https://orcid.org/0000-0002-5945-5419
Karen Yuliana Ramírez Iriarte
https://orcid.org/0000-0002-9497-3991
Luisa Alejandra Maya Caicedo
https://orcid.org/0000-0003-4435-0195
Wilmer Orlando Aponte Barrios
https://orcid.org/0000-0001-9203-8273
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
Toxicidad pulmonar secundaria a bleomicina. Reporte de un caso
Pulmonary Toxicity Secondary to Bleomycin. A Case Report
Luis Eduardo Ramírez Bejarano1 , Karen Yuliana Ramírez Iriarte2
, Karen Yuliana Ramírez Iriarte2 , Luisa Alejandra Maya Caicedo3
, Luisa Alejandra Maya Caicedo3 , Wilmer Orlando Aponte Barrios2
, Wilmer Orlando Aponte Barrios2
1 Hospital Universitario Nacional de Colombia. Departamento de Neumología. Bogotá. Colombia.
2 Hospital Universitario Nacional de Colombia. Departamento de Radiología. Bogotá. Colombia.
3 Hospital Universitario Nacional de Colombia. Departamento de Medicina Interna. Bogotá. Colombia.
Autor CORRESPONSAL:
Luis Eduardo Ramírez Bejarano: lramirezb@hotmail.com
Resumen
La toxicidad pulmonar por antineoplásicos es muy variable dependiente del grupo farmacológico; la bleomicina es uno de los medicamentos en los que se ha reportado este evento. Este citostático puede lesionar el endotelio pulmonar y el epitelio alveolar para llevar a un proceso inflamatorio y fibrótico del intersticio con repercusiones potencialmente fatales.
A continuación, se presenta un caso de enfermedad intersticial tipo neumonía organizada asociada a bleomicina en un paciente de 68 años con diagnóstico linfoma Hodgkin clásico de tipo esclerosis nodular, con estudio imagenológico normal previo al tratamiento.
Palabras clave: bleomicina, toxicidad pulmonar, fibrosis pulmonar.
Abstract
Antineoplastic pulmonary toxicity is highly variable depending on the pharmacological group; bleomycin is one of the drugs in which this event has been reported. This cytostatic can injure the pulmonary endothelium and the alveolar epithelium to lead to an inflammatory and fibrotic process of the interstitium with potentially fatal repercussions.
The following is a case of interstitial disease type organizing pneumonia associated with bleomycin in a 68-year-old patient diagnosed with classical Hodgkin lymphoma of nodular sclerosis type, with imaging study prior to normal treatment.
Key words: bleomycin, pulmonary toxicity, pulmonary fibrosis.
Introducción
La bleomicina es un glicopéptido aislado del hongo Streptomyces verticillus. Su actividad antineoplásica se centra en la inducción directa de la muerte celular y la inhibición de la angiogénesis. Este antineoplásico se encuentra dentro de los esquemas para el manejo de linfomas, tumores de células germinales, sarcoma de Kaposi, entre otros.1
El mecanismo citotóxico de la bleomicina es dosis dependiente y presenta una incidencia de neumonitis intersticial del 3-5% y hasta 20%, con 300 mg y 500 mg, respectivamente. La toxicidad pulmonar puede manifestarse con distintos patrones en la tomografía computadorizada de tórax, tales como daño alveolar difuso, neumonía organizada, neumonía intersticial no específica o bronquiolitis. Los datos que subyacen a la fisiopatología de la toxicidad no son del todo conocidos y los disponibles en la actualidad son extraídos de modelos animales, no obstante, se conoce que la bleomicina debe ser activada para producir efectos citotóxicos a través de la generación de radicales libres de oxígeno.2
En la actualidad, el único tratamiento con una posible efectividad clínica es el uso temprano de corticoides para prevenir la falla respiratoria aguda y el desarrollo de fibrosis pulmonar.
Se presenta el caso de un paciente masculino, de 68 años, hipertenso e hipotiroideo, con historia de 8 meses de evolución de dolor abdominal y pérdida no intencionada de peso, asociado a síntomas constitucionales. Al examen físico, se evidencia adenopatía supraclavicular móvil, no dolorosa, distensión abdominal y ascitis. Se realizan estudios de extensión, entre ellos tomografía abdominal que evidencia un extenso conglomerado de adenopatías a nivel mesentérico y retroperitoneal, lo cual, aunado a la presencia de anemia microcítica, trombocitosis secundaria, deshidrogenasa láctica y b2 microglobulina elevada, hace considerar que estamos en presencia de un síndrome linfoproliferativo por probable linfoma de alto grado. El estudio se complementa con biopsia ganglionar y un TC de cuello contrastado que identifica adenomegalias de aspecto sospechoso en las zonas IV bilateral, VB izquierda y VI, TC de tórax con contraste con adenomegalias mediastínicas, hiliares y retroperitoneales con evidencia de lesión blástica en T12 de aspecto infiltrativo. El reporte de la biopsia del ganglio cervical confirma un linfoma Hodgkin tipo esclerosis nodular. La inmunohistoquímica es positiva en células grandes para: CD30, CD15, LMP1 débil, PAX5 y negativos para AE1/AE3, CD20 y CD3.
El linfoma Hodgkin se clasifica en un estadio IIIB y se inicia quimioterapia con protocolo ABVD (doxorrubicina (25 mg/m2), bleomicina (10 UI/m2) vinblastina (6 mg/m2) y dacarbazina (375 mg/m2). Después del tercer ciclo, el paciente presenta deterioro de su clase funcional, tos con expectoración blanquecina, rinorrea hialina, disnea, cefalea, sin fiebre y se descarta infección por Covid–19 (Tabla 1).
Tabla 1.
Laboratorios
|
LDH |
234 mg/dl |
|
b2 microglobulina |
4.11 mg/L |
|
Depuración de creatinina |
82.65mg/min |
|
HBsAg |
Negativo |
|
HVC |
Negativo |
|
RPR |
No reactivo |
|
Ecocardiograma TT |
Fevi 73% función sistólica/diastólica ventricular conservada. |
|
PCR Covid 19 |
Negativa |
LDH: deshidrogenasa láctica
HbsAg: antígeno de superficie de hepatitis B
HVC: virus de hepatitis C
RPR: reagina plasmática rápida
FEVI: fracción de eyección del ventrículo izquierdo
PCR: reacción en cadena de la polimerasa
Se realiza TC de tórax de alta resolución donde se observa engrosamiento de los septos interlobulillares con broquiolectasias por tracción sin gradiente apico-basal y con distribución predominantemente bronquiolocéntrica. Además, se pueden observar algunas zonas de vidrio esmerilado sutiles y consolidaciones con broncograma aéreo de distribución bronquiolocéntrica y periféricas que podrían corresponder a zonas agregadas en organización (Figura 1). Estas imágenes no se encontraban presentes en el estudio tomográfico realizado previo al inicio de quimioterapia, sin evidencia de compromiso estructural pulmonar (Figura 2). Al evaluar la temporalidad de la aparición de los hallazgos imagenológicos y el deterioro clínico, se considera que se trata de una toxicidad por agente quimioterápico (bleomicina). En conjunto con neumología y hematología se decide modificar la quimioterapia, quedando con un protocolo AVD (sin bleomicina). También, se inicia terapia con esteroides orales a dosis de 1 mg/kg/día durante 3 semanas, se observa mejoría sintomática y a evaluar mejoría imagenológica en 6 semanas.
Figura 1.
A. Tomografía de tórax de alta resolución corte coronal, con evidencia de bronquiolectasias por tracción, vidrio esmerilado, sin gradiente apico-basal. B. Tomografía de tórax de alta resolución corte axial, patrón de vidrio esmerilado, consolidaciones con broncograma aéreo distribución bronquiolocentricas y periféricas.
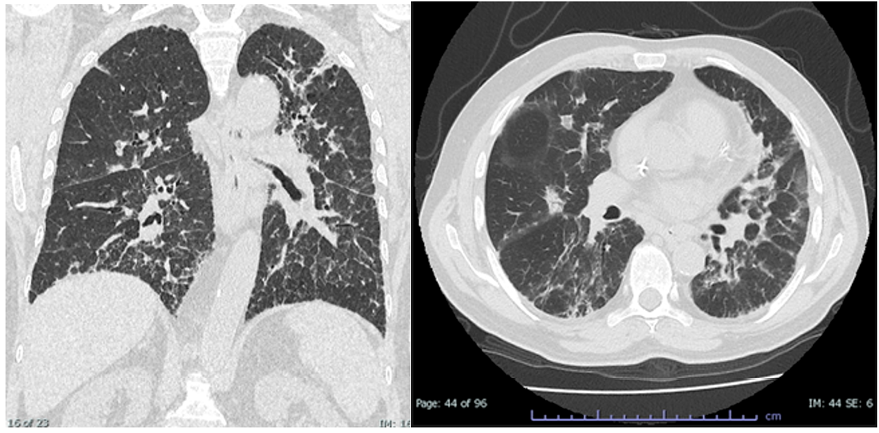
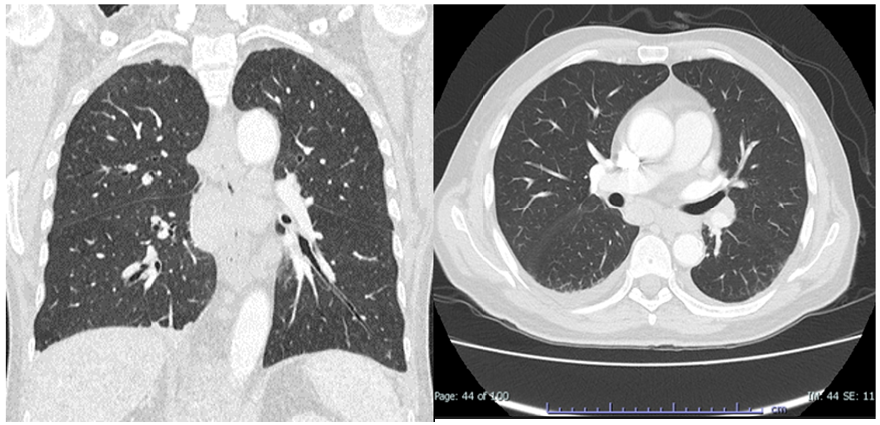
Figura 2.
Tomografía de tórax de alta resolución corte coronal (A) y axial (B) no se evidencia dilataciones bronquiales, no compromiso intersticial ni áreas de consolidación.
Discusión
Las reacciones secundarias al uso de bleomicina incluyen rash cutáneo, mucositis e hipersensibilidad. De todos los efectos adversos, la toxicidad pulmonar es el más grave, pues alcanza una incidencia de hasta el 46% teniendo en cuenta que es dosis dependiente con una mortalidad hasta del 3%. Habitualmente, la bleomicina se utiliza sola o en combinación con otros agentes quimioterapéuticos en el tratamiento de carcinomas de células escamosas, cáncer testicular y linfoma de Hodgkin.1,2
Uno de los mecanismos de lesión corresponde a la reacción química de la activación de la bleomicina por medio del Fe+2, que reduce el oxígeno y forma radicales libres que alteran la membrana alveolocapilar al oxidar lípidos, clivar ARN y ADN e hidrolizar proteínas. Esto ocurre principalmente en el pulmón y piel, dado a la ausencia en estos órganos de la enzima hidrolasa de bleomicina. El compromiso pulmonar se caracteriza por daño al epitelio alveolar, metaplasia del epitelio bronquial, daño a la membrana basal, infiltrado de células inflamatorias en los alvéolos y septos alveolares y daño endotelial.3,4
La toxicidad pulmonar inducida por bleomicina puede causar una variedad de patrones en la tomografía de tórax, tales como daño alveolar difuso con patrón tipo opacidades en vidrio esmerilado o GGO (por sus siglas en inglés), el cual se puede exacerbar con la administración de oxígeno como presentación aguda. La neumonía organizada, neumonía intersticial no específica o bronquiolitis son comúnmente vistas en fases subagudas y el patrón de fibrosis se observa en fase crónica.4-6 Nuestro paciente presentaba engrosamiento de los septos interlobulillares, reticulación subpleural y bronquiolectasias por tracción, lo que sugiere signos de fibrosis pulmonar, pero también focos de vidrio esmerilado y consolidaciones peribroncovasculares y subpleurales que podrían sugerir zonas de neumonía en organización y/o daño alveolar difuso agudo o subagudo (Figura 1 y 2).
La evaluación de causalidad se realizó utilizando la escala de Naranjo et al7 que determina la probabilidad de si una reacción adversa de la droga (RAD) es realmente debido a la droga más bien que al resultado de otros factores. En este caso, el puntaje alcanzó un total de 6 puntos lo que indica que es probable que la RAD sea inducida por la bleomicina.
Cuando hay toxicidad pulmonar por bleomicina, el tratamiento consiste en suspender el medicamento causante. El uso de glucocorticoides está reservado para pacientes con toxicidad pulmonar sintomática ya que se ha descrito la resolución espontánea de las opacidades radiográficas en pacientes asintomáticos. Aunque ningún estudio controlado en humanos ha examinado sistemáticamente la eficacia de los corticosteroides, probablemente se justifica su uso por los informes de series de casos que han descrito una recuperación sustancial. La dosificación óptima de corticoides se desconoce, así como la duración de la terapia. Sin embargo, la mayoría de los autores recomiendan iniciar tratamiento con prednisona a una dosis de 0,75 a 1 mg/kg de peso, con resolución de los hallazgos imagenológicos en promedio a los 15 meses según la literatura.6
En nuestro caso, se inició prednisolona a dosis de 1 mg/kg/día y se ajustó el protocolo quimioterapéutico a AVD, lo que logró mejoría clínica de la sintomatología hasta la fecha. El paciente tiene pendiente un control de tomografía de tórax a los 3 meses después del cambio de tratamiento.
La resolución completa de los síntomas y la normalización de las pruebas de función pulmonar e imágenes son menos probables de producirse en los casos en que: 1) el diagnóstico se retrasa; 2) se continúa con el tratamiento quimioterápico completo o 3) se desarrolla fibrosis pulmonar. Por ello, la sospecha clínica precoz es muy importante y puede garantizar un mejor pronóstico.
La toxicidad pulmonar por bleomicina es una complicación infrecuente de mal pronóstico que debe ser buscada activamente mediante tomografía de tórax. En la fase aguda, presenta patrones radiológicos que pueden ser reversibles con la suspensión del tratamiento y el potencial beneficio de los esteroides. Por dicho motivo, el reconocimiento de estos patrones tomográficos es importante para realizar un diagnóstico y tratamiento precoz.
Financiamiento: los autores declaran que el trabajo no tuvo financiamiento
Conflicto de interés: los autores declaran que no tienen conflictos de intereses relacionados con el tema de esta publicación.
Contribuciones: LERB: Concepción y diseño, revisión de la literatura, redacción y corrección del manuscrito, aprobación final del manuscrito. KYRI: Revisión de literatura, redacción y corrección del manuscrito, aprobación final del manuscrito. LAMC: Concepción y diseño, revisión de la literatura, redacción y corrección del manuscrito, aprobación final del manuscrito. WOAB: Concepción y diseño, revisión de la literatura, redacción y corrección del manuscrito, aprobación final del manuscrito.
El Editor en Jefe, Dr. Francisco Arancibia, realizó el seguimiento del proceso de revisión y aprobó este artículo.