

CASO CLÍNICO | Respirar, 2023; 15(3): 211-216 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.15.3.7
Recibido:
13 abril 2023
Aceptado:
13 julio 2023
Iván Triana
https://orcid.org/0000-0002-8349-5576
Angela Aguirre
https://orcid.org/0009-0002-2999-1250
Jairo Roa
https://orcid.org/0009-0002-3149-7390
Olga Milena García
https://orcid.org/0000-0002-9921-883X
Germán Esguerra
https://orcid.org/0009-0004-5402-7230
Javier Segovia
https://orcid.org/0000-0001-8971-0911
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
Carcinomatosis peritoneal en cáncer de pulmón: revisión de la literatura con reporte de caso
Peritoneal Carcinomatosis in Lung Cancer: Literature Review with a Case Report
Iván Triana , Angela Aguirre
, Angela Aguirre , Jairo Roa
, Jairo Roa , Olga Milena García
, Olga Milena García ,
,
Germán Esguerra , Javier Segovia
, Javier Segovia
Fundación Santa Fe de Bogotá, Colombia
Autor CORRESPONSAL:
Iván Camilo Triana: camilotrianaa@gmail.com
Resumen
En Colombia, para 2020, el cáncer de pulmón se reportó como la segunda neoplasia con mayor incidencia y la primera con mayor tasa de mortalidad según las cifras del ministerio de salud de Colombia. El compromiso peritoneal en el cáncer de pulmón es algo extremadamente raro, se considera <1%. A continuación, exponemos un caso de carcinomatosis peritoneal en cáncer de pulmón en un hospital en la ciudad de Bogotá. Se incorpora una posterior revisión descriptiva de la literatura de los casos clínicos de carcinomatosis peritoneal en cáncer de pulmón reportados en la literatura mundial en los últimos 20 años, con el objetivo de resumir las principales características de estos pacientes que permiten plantear hipótesis de su enfoque terapéutico y pronóstico.
Palabras clave: carcinomatosis, metástasis, cáncer de pulmón, célula no pequeña, perfil molecular.
Abstract
In Colombia for 2020, lung cancer was reported as the fifth neoplasm with the highest incidence and the second with the highest mortality rate. Peritoneal involvement in lung cancer is extremely rare, it is considered <1%. Next, we present a case of peritoneal carcinomatosis in lung cancer in Bogotá, with a subsequent literature review of the literature of clinical cases of peritoneal carcinomatosis in lung cancer reported in the world literature in the last 20 years. The aim is to summarize the main characteristics of these patients that allow to hypothesize their prognostic and therapeutic approach.
Key words: lung cancer, carcinomatosis, molecular profile.
Introducción
El cáncer de pulmón es la segunda neoplasia con mayor incidencia a nivel mundial y la primera neoplasia con mayor tasa de mortalidad. En Colombia para 2020, se reportó como la quinta neoplasia con mayor incidencia y la segunda con mayor tasa de mortalidad, según GLOBOCAN 2020. Con el avance de las tecnologías en salud se han desarrollado múltiples terapias sistémicas que han ido mejorando los tiempos libres de progresión y de supervivencia global. Dentro de ellas, se cuenta con la inmunoterapia, terapia blanco-dirigida (EGFR, ALK, ROS1). El compromiso peritoneal en el cáncer de pulmón como debut o como progresión es algo extremadamente raro, se considera <1%. Actualmente no existe claridad sobre el pronóstico ni la mejor opción terapéutica para estos pacientes, dado que el perfil molecular de estas neoplasias es poco conocido y no es una patología común, habiendo limitación en la práctica médica sin un mayor conocimiento en el manejo.
Con el fin de resumir la mayor evidencia disponible en estos pacientes, se realizó una revisión de literatura en Pubmed, EMBASE, Cochrane, LILACS, en idioma inglés y español, utilizando la ecuación de búsqueda (“peritoneal carcinomatosis” AND “lung cancer”) con sus términos Mesh asociados y en traducción al español. Se incluyeron casos con confirmación patológica de los implantes peritoneales y diagnóstico patológico de cáncer de pulmón de célula no pequeña. Se encontraron 159 casos en los últimos 20 años, ningún estudio prospectivo, solo se encontraron series de casos, ningún caso reportado en Latinoamérica.
A continuación, exponemos un caso de carcinomatosis peritoneal en cáncer de pulmón en Bogotá, Colombia; con un posterior análisis descriptivo de la literatura encontrada.
Caso clínico
Paciente femenino de 42 años sin antecedentes patológicos, ni exposición a cigarrillo. Ingresa por cuatro meses de dolor lumbar irradiado a glúteo izquierdo que dificultaba la marcha. Se realiza una resonancia magnética de columna con evidencia de lesiones infiltrativas de características neoplásicas en L2-L4. Ante sospecha de malignidad, se realiza tomografía de tórax y abdomen con hallazgos de masa espiculada en pulmón derecho en el segmento lateral del lóbulo medio de aspecto neoplásico, derrame pleural ipsilateral, moderada cantidad de líquido perihepático y periesplénico, algunos ganglios subcentrimétricos en cadenas ilíacas que realzan con el contraste, múltiples lesiones óseas por compromiso poliostótico esclerótico y lítico (figura 1).
Figura 1.
Tomografía de tórax donde se evidencia lesión primaria

Se realiza broncoscopia para obtener material histológico de la lesión en pulmón, con hallazgos en la patología compatible con adenocarcinoma infiltrante positivo TTF1 negativo para P40, compatible con primario pulmonar. Ante hallazgos en abdomen, se decide realizar PET CT (figura 2), con múltiples marcaciones peritoneales que indican alta sospecha de malignidad. Se presenta caso en junta multidisciplinaria, donde se considera posible compromiso abdominal por un segundo primario vs. compromiso metastásico por cáncer de pulmón, por lo que se decide llevar a laparoscopia diagnóstica. En material histológico, se evidencian múltiples implantes peritoneales con hallazgos en patología de neoplasia epitelial, con reactividad para citoqueratina 7, TTF1, napsina y negatividad para citoqueratina 20, calretinina, wt1, pax8, cdx2 y gata3, considerando compromiso metastásico de origen pulmonar.
Figura 2.
PET–CT al diagnóstico
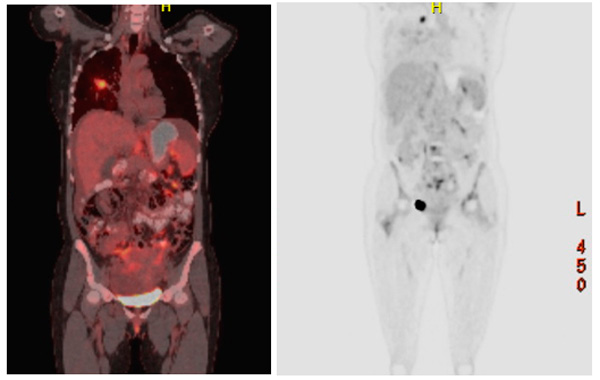
Con estos hallazgos se lleva nuevamente a junta multidisciplinaria donde se considera paciente con adenocarcinoma de pulmón estadio IV, con carcinomatosis peritoneal, estudio de inmunohistoquímica con EGFR y ALK negativo, PD1L>5% y se inicia manejo por oncología con carboplatino, pemetrexed y pembrolizumab. Actualmente, lleva un tiempo de seguimiento de 9 meses con enfermedad estable. Dentro de los primeros dos meses, la paciente presenta ascitis a tensión que requiere drenaje mediante paracentesis, posteriormente la semiología abdominal mejora hacia el tercer mes. No ha vuelto a requerir nuevo procedimiento abdominal, ni referir nuevos síntomas gastrointestinales. Adicionalmente a nivel pulmonar, la paciente presenta mejoría del derrame pleural sin requerir de procedimientos invasivos adicionales.
Revisión descriptiva de la literatura
Se pudo realizar un análisis descriptivo en 130 casos de los 159 reportados en la literatura. Se encontró: promedio de edad 54 años, exposición a cigarrillo en el 65,6%, adenocarcinoma 86%, escamocelular 2,3%, mutación EGFR en 25%, ALK 4,4%, ROS1 3%, mutación no testeada 18,7%. En todos los casos de la literatura, no hay información sobre la expresión de PDL1. Se realizó un cálculo de mediana de supervivencia según los informes, con una mediana de 3–12 meses. En la tabla 1 se resumen todas las características de los casos descritos en la literatura.
Tabla 1.
Revisión descriptiva de la literatura
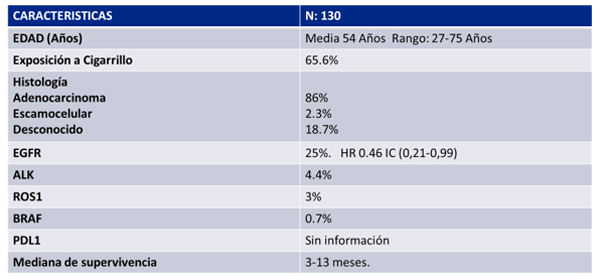
En un estudio de series de casos, se reportó un análisis multivariado de 43 casos, donde se evidenció que los pacientes con EGFR positivo tenían un HR 0.46 IC (0,21-0,99) con una p <0.05. Sin embargo, hay que entender el tipo de estudio y sus limitaciones.
Discusión
Como se ha descrito previamente en la literatura, el cáncer de pulmón tiene preferencia metastásica a nivel cerebral y hepático. No obstante, se han descrito y documentado casos en la literatura de metástasis viscerales-peritoneales, sobre todo en hallazgos de autopsias antiguas del 2%. Teniendo en cuenta la baja incidencia, se demuestra la importancia de la publicación de estos tipos de casos en la literatura.
En el caso de la metástasis a nivel de la carcinomatosis peritoneal (CP), se asocia en mayor frecuencia al subgrupo del adenocarcinoma y carcinoma de células grandes, como se evidenció en nuestra revisión descriptiva de casos.1-3 Las metástasis documentadas de primario pulmonar son el cerebro (47%), los huesos (36%), el hígado (22%), las glándulas suprarrenales (15%), la cavidad torácica (11%) y los ganglios linfáticos distantes (10%). La carcinomatosis peritoneal (CAP) es un evento clínico raro en pacientes con cáncer de pulmón (CP).1,2
Recientemente, se publicó una revisión por Siragusa L. et al., con 2783 pacientes con cáncer de pulmón y compromiso peritoneal. En esta revisión, se calculó que la prevalencia de compromiso peritoneal fue aproximadamente del 2% del global de pacientes revisados, lo que indica lo poco frecuente de esta asociación, como se ha identificado previamente; y se incluyeron pacientes de célula pequeña, a diferencia de nuestra revisión que es exclusiva de célula no pequeña.4 Adicionalmente, en esta revisión no hay confirmación histológica de los implantes peritoneales, lo que permite el diferencial de que se trate de segundos primarios o no sean un primario pulmonar, lo cual fue el reto diagnóstico de nuestro caso clínico y es el reto con el cual se enfrenta el personal médico en la mayoría de estos pacientes.4 Es importante que nuestra revisión incluye los pacientes con debut peritoneal del cáncer de pulmón; en Siragusa L. et al. no se identifica esta cronología en todos los casos, lo cual deja aún la mención de que el debut peritoneal en cáncer de pulmón de célula no pequeña es algo extremadamente raro y puede implicar mecanismos moleculares diferentes.4
La explicación de la metástasis a nivel peritoneal no es del todo clara, aún así, hay diferentes teorías que podrían explicarla, como es el caso de expansión de contigüidad secundaria a la afectación de la serosa y su sustitución por el tumor donde finalmente da como resultado la exfoliación de las células tumorales sobre la cavidad peritoneal. También la expansión iatrogénica donde al momento de extirpación del tumor da como consecuencia la liberación de células tumorales. La tercera causa es la diseminación a nivel hematógena, entrando a la circulación sistémica y ganglios linfáticos. Sin embargo, el mecanismo de diseminación peritoneal aislada de un cáncer de pulmón no se conoce con exactitud.5
Teniendo en cuenta la inespecificidad y variabilidad de los síntomas clínicos en los estadios iniciales o estadios más avanzados, se ha vuelto un mayor reto diagnóstico. Esto ha generado que estos pacientes se diagnostiquen en condiciones muy avanzadas de la enfermedad, lo que limita un tratamiento oportuno, como sucedió en nuestro caso clínico.5
No obstante, es a través del tiempo que se han desarrollo una sumatoria de elementos diagnósticos como es el caso de la disponibilidad de nuevas técnicas imagenológicas; la tomografía computarizada y la tomografía por emisión de positrones.2,5,6 El análisis y estudios de líquido pleural y peritoneal en caso de ascitis con presencia de células tumorales, estudios inmunohistoquímico al momento de la biopsia y marcadores tumorales son herramientas adecuadas para el diagnóstico de CAP. Según diferentes autores, la presencia de mutaciones de EGFR y KRAS, reordenamientos de ALK y, rara vez, MET se podrían identificar en esta condición oncológica a nivel peritoneal.7-9
De igual manera, en la literatura se esclarece que una de las mutaciones más usuales a encontrar es TTF1 en el subgrupo de adenocarcinoma de pulmón. Este es un marcador importante para tener en cuenta en la identificación, diagnóstico del cáncer y origen primario en el caso de pacientes con metástasis peritoneal. Diferentes series reportadas hablan de una sensibilidad que osciló entre 57,5% y 76%.10,11
En la revisión de la literatura de Hanane K. et al.,3 las características genéticas poblacionales muestran, en la mayoría de los casos, la presencia de EGRF y, en menor medida, ALK, KRAS, BRAF, ROS1 y MET, congruente con nuestra revisión de la literatura que incluyó un mayor número de pacientes.
Con respecto a la sobrevida de esta condición oncológica, a pesar del manejo con quimioterapia, radioterapia y cirugía en estos pacientes, es aún muy precario, teniendo en cuenta que no se cuenta con evidencia robusta, guías y pautas que busquen homogeneizar el tratamiento con un claro beneficio en el paciente. Desafortunadamente, en la actualidad se estima una sobrevida de 2 a 6 meses en la mayoría de los casos reportados. Así mismo, se brinda un tratamiento paliativo en la mayoría de los casos.3,11 No obstante, hay documentación de sobrevida en algunos casos de hasta 12 meses.5
A su vez, estas sobrevidas están asociadas con una buena tipificación inmunohistoquímica y un tratamiento direccionado, como es el caso de pacientes con EGRF, con una respuesta parcial a los inhibidores de tirosina quinasa;8 o en el caso de TP53, KRAS, son mutaciones que se asocian con una menor supervivencia y una peor respuesta a la radiación y las terapias adyuvantes con cisplatino, sin contar aún con algún esquema que permita aumentar la sobrevida.5
En la información recopilada se sabe que, a pesar de la quimioterapia o tratamientos adicionales, el resultado de los cánceres de pulmón con metástasis peritoneal no es muy favorable comparado con otro tipo de metástasis. Actualmente se habla de posibles terapias futuras que pudieran modificar la vida de pacientes con este diagnóstico como es el caso de la nanoterapia basada en la inmunoterapia del macrófago, pero es un tema que debe ser abordado con mayor profundidad cuando tengamos claridad del real beneficio.12
Mecanismo de metástasis peritoneales
Las células siguen el flujo del líquido ascítico siendo las áreas de acumulo por fuerza de gravedad las más frecuentes. Hay 3 mecanismos descritos como son diseminación hematógena, implantación directa y ascitis quilosa; el primero es el más frecuente en enfermedad de origen extraperitoneal siendo realmente lesiones metastásicas al intestino delgado y el mesenterio.13
Respecto al tratamiento, no hay información que permita direccionar de manera diferente por compromiso anatómico peritoneal,13 por lo que el tratamiento sistemático se basa en el perfil molecular. Algunos datos retrospectivos sugieren factor de mal pronóstico y probablemente menor efectividad de inhibidores de punto de chequeo.14
Conclusión
La aparición de metástasis peritoneal secundario al cáncer de pulmón es una condición muy rara, suele acompañarse de otras metástasis sistémicas y otorga un peor pronóstico. No obstante, a través de los años, se ha tenido un mayor número de reportes y series de casos en la literatura, lo que hace evidente la necesidad de terapias con mayor impacto en la sobrevida de estos pacientes. Es claro que el tratamiento en esta condición debe ser multidisciplinario, direccionado según las características inmunohistoquímicas. Este es un punto de investigación y de futuros estudios.
Financiamiento: los autores declaran que el trabajo no tuvo financiamiento.
Conflictos de interés: los autores declaran que no tienen conflictos de intereses relacionados con el tema de esta publicación.
Contribuciones de los autores: todos los autores participaron en: análisis formal, conceptualización, curaduría de datos, escritura, revisión y edición, metodología, redacción, supervisión, validación.
El Editor en Jefe, Dr. Carlos Luna, realizó el seguimiento del proceso de revisión y aprobó este artículo.
Referencias