

ARTÍCULO ORIGINAL | Respirar, 2023; 15(3): 168-175 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.15.3.3
Recibido:
12 abril 2023
Aceptado:
17 agosto 2023
Misleidis Sardiñas Aragón https://orcid.org/0000-0002-9798-5031
Grechen Caridad García León
https://orcid.org/0000-0002-9593-6711
María Rosarys Martínez Romero
https://orcid.org/0000-0001-5947-732X
Raúl Díaz Rodríguez
https://orcid.org/0000-0001-9107-124X
Lilian María Mederos Cuervo
https://orcid.org/0000-0001-7431-2216
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
Identificación de micobacterias no pigmentadas de crecimiento rápido por el método molecular Genotype® Mycobacterium CM
Identification of Fast-Growing Non-Pigmented Mycobacteria by the Genotype® Mycobacterium CM Molecular Method
Misleidis Sardiñas Aragón , Grechen Caridad García León
, Grechen Caridad García León , María Rosarys Martínez Romero
, María Rosarys Martínez Romero , Raúl Díaz Rodríguez
, Raúl Díaz Rodríguez , Lilián María Mederos Cuervo
, Lilián María Mederos Cuervo
Laboratorio Nacional de Referencia e Investigaciones en Tuberculosis, Lepra y Micobacterias, Centro Colaborador OPS/OMS. Instituto de Medicina Tropical Pedro Kourí (IPK) La Habana, Cuba.
Autor CORRESPONSAL:
Misleidis Sardiñas Aragón, misle@ipk.sld.cu
Abreviaturas: MNT: micobacterias no tuberculosas, MNPCR: micobacterias no pigmentadas de crecimiento rápido, PVVIH: personas viviendo con el virus de inmunodeficiencia humana, MCR: micobacterias de crecimiento rápido, EPOC: enfermedad pulmonar obstructiva crónica.
Resumen
Introducción: las micobacterias no tuberculosas (MNT) forman un grupo heterogéneo de microorganismos que pueden provocar infección en humanos. Las micobacterias no pigmentadas de crecimiento rápido (MNPCR) tienen interés clínico debido al número creciente de pacientes infectados por estas y a la dificultad del tratamiento. Dentro de ese grupo se reconocen como patógeno potencial Mycobacterium fortuitum, Mycobacterium abscessus y Mycobacterium chelonae. Estas especies han sido aisladas tanto de infecciones pulmonares como extrapulmonares. Objetivo: el objetivo de este trabajo es determinar la frecuencia de aislamiento de especies micobacterianas de crecimiento rápido no pigmentadas, a partir de muestras clínicas utilizando la técnica molecular diagnóstica GenoType® Mycobacterium CM. Material y Método: se analizaron 249 aislados de micobacterias no tuberculosas obtenidos a partir de muestras pulmonares y extrapulmonares procedentes de pacientes sintomáticos en el período enero 2018-diciembre 2022. Para la identificación de especies se utilizó la técnica molecular GenoType® Mycobacterium CM. Resultados: se obtuvieron 77 (30,9%) aislamientos de especies no pigmentadas de crecimiento rápido. Estas fueron identificadas en orden decreciente: Mycobacterium fortuitum 65 (84,4%), Mycobacterium abcessus 9 (11,6%) y Mycobacterium chelonae 3 (4%). Conclusiones: los resultados reafirman que la especie Mycobacterium fortuitum es la responsable de la mayor parte de las infecciones causadas por micobacterias de rápido crecimiento en humanos. La técnica diagnóstica GenoType® Mycobacterium CM es una herramienta útil para la identificación rápida de micobacterias con resultados precisos en menor tiempo, logra acortar significativamente el tiempo diagnóstico y permite la aplicación temprana del tratamiento específico, lo que evita la diseminación de la infección.
Palabras claves: micobacterias no tuberculosas, Mycobacterium fortuitum, Mycobacterium chelonae, Mycobacterium abscessus, GenoType® Mycobacterium CM.
Abstract
Introduction: non-tuberculous mycobacteria (NTM) form a heterogeneous group of microorganisms that can cause infection in humans. Fast-growing non-pigmented mycobacteria (MNPCR) are of clinical interest due to the increasing number of patients infected by them and the difficulty of treatment. Within this group, Mycobacterium fortuitum, Mycobacterium abscessus and Mycobacterium chelonae are recognized as potential pathogens; these species have been isolated from both pulmonary and extrapulmonary infections. Objective: the objective of this work is to find the frequency of isolation of fast-growing non-pigmented mycobacterial species, specifically the Mycobacterium fortuitum complex, from clinical samples using the GenoType® Mycobacterium CM diagnostic molecular technique. Material and Method: 249 isolates of non-tuberculous mycobacteria obtained from pulmonary and extrapulmonary samples from symptomatic patients in the period January 2018-December 2022 were analyzed. The GenoType® Mycobacterium CM molecular technique was used to identify the species. Results: 77 (30.9%) isolates of fast-growing non-pigmented species were obtained, these were identified in decreasing order: Mycobacterium fortuitum 65 (84.41%), Mycobacterium abcessus 9 (11.68%) and Mycobacterium chelonae 3 (4%). Conclusions: the results reaffirm that the Mycobacterium fortuitum complex is responsible for most infections caused by fast-growing mycobacteria in humans. The GenoType® Mycobacterium CM diagnostic technique is a useful tool for the rapid identification of mycobacteria; it provides accurate results in less time, significantly shortening the diagnostic time, it allows the early application of specific treatment, thus avoiding the spread of infection.
Keywords: Non-tuberculous mycobacteria, Mycobacterium fortuitum, Mycobacterium chelonae, Mycobacterium abscessus, GenoType® Mycobacterium CM.
Introducción
Dentro del género Mycobacterium, la incidencia de micobacterias no tuberculosas (MNT) asociadas a diferentes patologías pulmonares y extrapulmonares cada vez es mayor. Las MNT están ampliamente distribuidas en la naturaleza; agua, suelo y animales. Dentro de ellas, las micobacterias de crecimiento rápido (MCR) aproximadamente son la mitad de las especies descritas, y el grupo conformado por especies no pigmentadas conforma el mayor porcentaje de aislamiento. El espectro de infecciones causadas por MCR es enormemente amplio e incluye numerosos síndromes clínicos como son: infecciones respiratorias, piel y partes blandas, infecciones asociadas a biomateriales y otras; cada una de ellas plantea problemas terapéuticos específicos.1, 2
Llama la atención el importante aumento de las infecciones causadas por estos organismos, tanto localizadas como diseminadas, incluso pseudo brotes en instituciones de salud. Este incremento se presenta principalmente en pacientes con factores de riesgo; VIH+, onco-hematológicos, receptores de trasplantes, patologías crónicas como la EPOC, fibrosis quística y otras. Este tipo de paciente también es propenso a desarrollar coinfección entre Mycobacterium tuberculosis y otras especies no tuberculosas.3,4
Las especies más representativas de este grupo en cuanto a su relevancia clínica son: Mycobacterium fortuitum, Mycobacterium chelonae y Mycobacterium abscessus. Sin embargo, gracias al desarrollo de técnicas analíticas como la espectrometría de masas, se han descrito otras especies pertenecientes al complejo Mycobacterium fortuitum capaces de causar enfermedades humanas: M. fortuitum, M. peregrinum, M. mucogenicum, M. senegalese, M. mageritense, M. septicum, M. alvei, M. houstonense, M. boenickei, M. conceptionense, M. porcinum, M. neworleansense, M. brisbanense y M. setense.5,6
El objetivo de este trabajo es determinar la frecuencia de aislamiento de especies micobacterianas de crecimiento rápido no pigmentadas, a partir de muestras clínicas utilizando la técnica molecular diagnóstica GenoType® Mycobacterium CM.
Material y métodos
Se realizó un estudio descriptivo de corte transversal en el cual se analizaron 249 aislados de MNT obtenidos en la sección de diagnóstico del Laboratorio Nacional de Referencia e Investigaciones de Tuberculosis/Lepra/Micobacterias, Centro Colaborador OPS/OMS del Instituto de Medicina Tropical Pedro Kourí (IPK), y otros aislados enviados para su identificación de los laboratorios de TB de los Centros Provinciales de Higiene, Epidemiología y Microbiología (CPHEM) del país. En el período entre enero ٢٠١٨-diciembre 2022. Para su identificación, se utilizó la técnica molecular GenoType® Mycobacterium CM (Hain Lifescience GmbH), siguiendo las instrucciones del fabricante.7
Los aislamientos de MNT analizados cumplieron con los criterios establecidos por la American Thoracic Society para el diagnóstico de enfermedad pulmonar y extrapulmonar por MNT.8
Muestra pulmonar:
– Esputo: dos o más cultivos (+)
– Aspirado bronquial: cultivo (+) o baciloscopia (+)
Muestra extrapulmonar:
– Biopsia: cultivo (+)
– Muestras estériles (líquidos corporales): cultivo (+)
– Otras: cultivo (+)
La transportación y traslado de los aislados procedentes de los CPHEM cumplió con las normas de bioseguridad establecidas para los laboratorios de micobacteriología.9, 10
Aspectos éticos
Por el tipo de estudio que se realizó, no se requirió de consentimiento informado de los pacientes involucrados en esta investigación. El trabajo se llevó a cabo en cabinas de bioseguridad clase II, según las normas y procedimientos del laboratorio para el trabajo con micobacterias. Los nombres de los pacientes involucrados se mantuvieron de manera confidencial. No hubo conflicto de intereses entre los autores. El protocolo de investigación fue evaluado y aprobado por la Comisión Científica Especializada de Microbiología y el Comité de Ética de Investigación-IPK.
Resultados
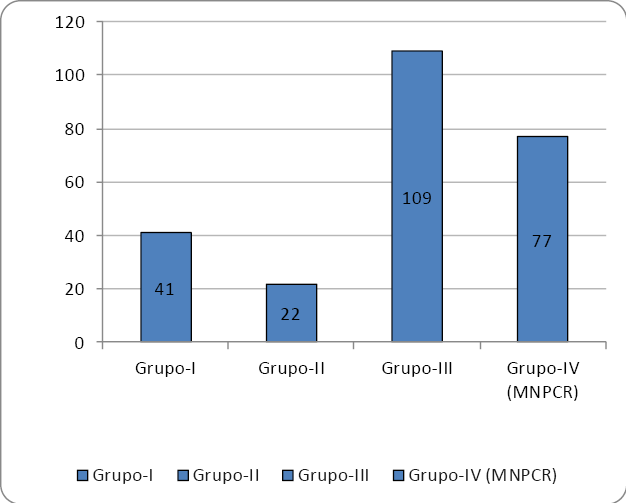
La figura 1 muestra los resultados de todos los aislamientos de MNT obtenidos durante este período según clasificación de Runyon. Como se puede observar, los grupos predominantes fueron el Grupo III y el Grupo IV, específicamente las MNPCR.
Figura 1.
Muestra los resultados obtenidos según clasificación de Runyon.
En la tabla 1 se observan los resultados obtenidos mediante la utilización de la prueba molecular diagnóstica GenoType® Mycobacterium CM para la identificación de MNPCR. El mayor porcentaje correspondió a las especies Mycobacterium fortuitum, Mycobacterium chelonae y Mycobacterium abcessus, especies pertenecientes al Grupo IV según clasificación descrita por Runyon.
Tabla 1.
Muestra los resultados obtenidos en la identificación molecular mediante el ensayo GenoType® Mycobacterium CM de los aislados de MNPCR.
|
Mycobacterium GenoType CM |
N° |
(%) |
Patrón de bandas |
|
M. fortuitum |
65 |
84.4 |
1,2,3,7,14 |
|
M. abscessus |
9 |
11.7 |
1,2,3,5,6,10 |
|
M. chelonae |
3 |
3.9 |
1,2,3,5,10 |
|
Total |
77 |
|
|
Discusión
Los resultados obtenidos en este estudio reafirman la presencia de especies micobacterianas pertenecientes a todos los grupos, según clasificación descrita por Ernest H. Runyon. Dentro de las especies de crecimiento lento, el Grupo III fue el más representativo. De las especies de crecimiento rápido pertenecientes al Grupo IV, las más representativas fueron las especies no pigmentadas; dentro de estas Mycobacterium fortuitum fue más predominante. Ambos resultados concuerdan con los descritos en la literatura científica revisada. Las infecciones por MNPCR seguirán siendo un desafío inherente para los médicos por las dificultades que presentan para el diagnóstico y tratamiento.11,12
Se debe señalar que del total de aislamientos de MNT, la mayoría eran procedentes de PVVIH. Durante las últimas tres décadas se ha observado un notable incremento de las infecciones causadas por MCR, tanto localizadas como diseminadas, así como de los brotes nosocomiales provocados por contaminación de equipos médicos; este aumento está también asociado al desarrollo de la mesoterapia. El cultivo e identificación de estas especies son requisitos imprescindibles para el diagnóstico. La tinción clásica de Ziehl-Neelsen es la recomendada, por cuanto la técnica de fluorescencia con auramina es negativa en el 30% de las MCR. La identificación taxonómica se realiza mediante técnicas fenotípicas, bioquímicas, analíticas y moleculares.11,13
El curso clínico y radiológico de estas infecciones, si son pulmonares, es muy similar al de la TB, evolucionando en la mayoría de los pacientes de forma crónica y lentamente progresiva. No obstante, en algunos casos, las lesiones pueden permanecer estables por periodos prolongados de tiempo, la resolución espontánea no ocurre y, en algunos casos, la curación de estas suele requerir la escisión quirúrgica. Desde el punto de vista clínico, las especies patógenas oportunistas, entre las que se encuentran las MCR, se consideran oportunistas mayores u oportunistas menores según la mayor o menor incidencia en enfermedad humana.12,14
A pesar de este resurgir de las MCR como patógenas emergentes, para considerar la posible patogenicidad de una determinada especie es preciso cumplir con los criterios de la American Thoracic Society tanto para el diagnóstico de enfermedad por MNT pulmonar o extrapulmonar.8 Además, se deben constatar los datos clínicos del paciente, la fuente de aislamiento y las características microbiológicas del cultivo. También, es importante considerar la evolución del paciente tras el tratamiento específico. El tratamiento para las micobacterias de crecimiento rápido difiere del de la TB, incluso del de otras micobacteriosis debido a la variable sensibilidad in vitro de este grupo. Estas pueden ser sensibles a antimicrobianos de amplio espectro.14,15 Incluye la administración de antibióticos de acuerdo con los patrones de sensibilidad y la actuación quirúrgica en el caso de linfadenitis, infecciones de la piel y tejidos blandos. La elección de un tratamiento varía en función de tres factores principales: la presentación clínica (pulmonar o extrapulmonar), la especie micobacteriana responsable de la infección y el estado inmunológico del paciente. Esto ha permitido orientar al clínico a seleccionar una terapia empírica.13-15
La especie Mycobacterium fortuitum es responsable de la mayor parte de las infecciones causadas por MNPCR. Sin embargo, muy pocos son los reportes de estas especies como patógenos potenciales en piel, tejidos blandos u otros; no porque no se produzcan sino porque los especialistas no asocian estos casos a este tipo de infección micobacteriana.12
Recientemente, Kumar et al. reportaron en un estudio de 475 aislados de MNT, procedentes de biopsias de piel y tejidos blandos, que la MNPCR aislada con mayor frecuencia fue M. abscessus 184 (38,7%), seguida por M. fortuitum 150 (31,5%) y M. chelonae con 72 (15%). Otros estudios también han documentado la aparición de estas especies asociadas a infecciones postquirúrgicas, debido a instrumentación contaminada.16-19
En Cuba, se ha implementado el uso de las técnicas moleculares diagnósticas (Genotype® Mycobacterium CM/AS) para la identificación de MNT. En el primer trabajo, se estudiaron 73 aislados de micobacterias no tuberculosas procedentes de muestras pulmonares recibidas de unidades de salud ubicadas en varias provincias del país. Los resultados mostraron que las especies pertenecientes al complejo Mycobacterium avium intracellulare y Mycobacterium fortuitum fueron las que tuvieron mayor frecuencia de aislamiento con 33 (45.2%) y 26 (35.6%), respectivamente. Además, se demostró que GenoType® Mycobacterium CM y GenoType® Mycobacterium AS son herramientas adecuadas (rápidas, sensibles y operativas) para la identificación de especies de MNT. Más recientemente, otro estudio fue realizado aplicando la técnica molecular Genotype® Mycobacterium CM, con el objetivo de identificar y diferenciar las especies pertenecientes al complejo Mycobacterium avium. En este estudio, se analizaron 217 aislados de MNT procedentes de pacientes sintomáticos respiratorios.
De estos, se obtuvieron 91 (42%) aislados, 34 (37,4%) Mycobacterium avium y 57 (62,6%) Mycobacterum intracellulare. Del total de aislamientos obtenidos, 50 procedían de PVVIH, lo que reafirma que los pacientes que por diversas causas presenten algún tipo de deterioro en su barrera inmunológica son más susceptibles a este tipo de infecciones.21-23
El empleo de técnicas moleculares para la identificación de MNT ha logrado acortar significativamente el tiempo diagnóstico. Un ejemplo de estas son el Genotype® Mycobacterium CM y Genotype® Mycobacterium AS, con las cuales se han obtenido resultados muy precisos.21 Recientemente, se realizó un estudio donde se emplearon estas técnicas para la identificación de MCR comparadas con espectrometría de masas (MALDI-TOFMS) y secuenciación parcial del gen rpoß con análisis filogenético como método de referencia. Este estudio reafirmó que con la aplicación de la técnica Genotype® Mycobacterium CM se obtuvo una buena identificación y diferenciación de las especies pertenecientes al complejo Mycobacterium fortuitum.24
Conclusiones
Los resultados obtenidos en este estudio muestran que casi un tercio de las micobacterias no tuberculosas aisladas corresponden a especies micobacterianas de crecimiento rápido no pigmentadas (MNPCR) pertenecientes al Grupo IV y, de estas, la especie que tiene mayor porcentaje de aislamiento fue Mycobacterium fortuitum, lo que concuerda con otros estudios. Las infecciones por MNPCR seguirán siendo un desafío inherente para los médicos por las dificultades que presentan para el diagnóstico y tratamiento. La sospecha clínica temprana es muy necesaria junto con la utilización de técnicas moleculares diagnósticas de mayor sensibilidad, que implicaría mayor oportunidad de aplicar tempranamente el tratamiento específico y evitaría así la diseminación de la infección, sobre todo en los grupos de riesgo.
Financiamiento: los autores declaran que el trabajo no tuvo financiamiento.
Conflictos de interés: los autores declaran que no tienen conflictos de intereses relacionados con el tema de esta publicación.
Contribución de los autores: MSA: conceptualización, curación de datos, análisis formal, metodología, software, redacción de borrador original, revisión y edición. GCGL: metodología, software, redacción, revisión y edición. MRMR: redacción, revisión y edición. RDR: redacción, revisión y edición. LMMC: conceptualización, curación de datos, análisis formal, metodología, software, redacción de borrador original, revisión y edición.
El Editor en Jefe, Dr. Francisco Arancibia, realizó el seguimiento del proceso de revisión y aprobó este artículo.
Referencias
1. García-Martos P, García-Agudo L. Infecciones por micobacterias de crecimiento rápido. Enferm Infecc Microbiol Clin 2012; 30(4):192–200. Doi: 10.1016/j.eimc.2011.09.017
2. Carrillo-Quintero D, Bolaños-Rivero M, Hernández-Cabrera M, Cañas-Hernández F. Aislamiento de micobacterias de crecimiento rápido a partir de muestras de piel y tejidos blandos. Una etiología a tener en cuenta. Cartas científicas. Enferm Infecc Microbiol Clin 2014; 32(10):689–696. Doi: 10.1016/j.eimc.2014.03.005
3. Soto-Arquíñigo L, Manuel García-Pareja M, Eduardo Gotuzzo-Herencia E, Legua-Leiva P, Sánchez-Herrera M. Coinfección por Mycobacterium fortuitum y Mycobacterium tuberculosis en abscesos esplénicos en un paciente con VIH. Rev Peru Med Exp Salud Pública 2017; 34(2):328-31.
4. Gino Patrón-Ordóñez G, Llanos-Tejada F, Dayanne Benítez-Gamboa D, Espinoza-Chiong C. Coinfección por Mycobacterium abscessus y Mycobacterium tuberculosis en un paciente con síndrome de cushing exógeno y otras comorbilidades. Rev Peru Med Exp Salud Publica 2020; 37(4):762-6.
5. Ahmed I, Jabeen K, Hasan R. Identification of non-tuberculous mycobacteria isolated from clinical specimens at a tertiary care hospital: a cross-sectional study. BMC Infect Dis 2013; 13:493. Doi: 10.1186/1471-2334-13-493.
6. Guerrero I, Lidia García-Agudo L, Galán F, García-Martos P. Diferenciación de especies del complejo Mycobacterium fortuitum mediante espectrometría de masas. Enferm Infecc Microbiol Clin 2015; 33(1):66–69. Doi: 10.1016/j.eimc.2014.04.015.
7. GenoType Mycobacterium CM VER 2.0. [Internet]. [Consultado 15 Mar 2023]. Disponible en: www.hain-lifescience.de
8. American Thoracic Society. Diagnosis and treatment of disease caused by nontuberculous mycobacteria. Am J Respir Crit Care Med 1997;156:S1-S25. Doi: 10.1164/ajrccm.156.2.atsstatemen
9. OPS. Manual para el diagnóstico bacteriológico de la Tuberculosis. Normas y Guía Técnica, Módulo 3: Toma y transporte de muestras de esputo – PAHO. 2008. [Internet]. [Consultado 15 Mar 2023]. Disponible en: https://iris.paho.org/handle/10665.2/18616
10. Díaz A, Scappaticcio A. Guía de Bioseguridad en el diagnóstico de tuberculosis para laboratorios. Documentos técnicos para el laboratorio clínico. Departamento Laboratorio Biomédico Nacional y de Referencia, Instituto de Salud Pública de Chile. 2017. [Internet]. [Consultado 15 Mar 2023]. Disponible en: https://www.ispch.cl/sites/default/files/Gu%C3%ADa%20de%20Bioseguridad%20para%20el%20Diagn%C3%B3stico%20de%20TBC.pdf
11. Rivera-Olivero IA, Guevara A, Escalona A et al. Infecciones en tejidos blandos por micobacterias no tuberculosas secundarias a mesoterapia. ¿Cuánto vale la belleza? Enferm Infecc Microbiol Clin 2006; 24(5):302-6.
12. Martínez González S, Cano Cortés A, Sota Yoldic LA. Micobacterias no tuberculosas. ¿Una amenaza emergente? Arch Bronco neumol 2017; 53(10):554–560. Doi: 10.1016/j.arbres.2017.02.014
13. Galván L, López GP, Suárez D et al. Características clínicas y microbiológicas de los pacientes con aislamiento de Mycobacterium fortuitum en muestras respiratorias. Rev Clin Esp 2015;215 (Espec Congr):510.
14. Jaime Esteban J, Navas E. Tratamiento de las infecciones producidas por micobacterias no tuberculosas. Enferm Infecc Microbiol Clin 2018; 36(9):586–592. Doi: 10.1016/j.eimc.2017.10.008.
15. García-Coca M, Rodriguez-Sevilla G, Muñoz-Egea MC, Perez-Jorge C, Carrasco-Anton N, Jaime-Esteban J. Historical evolution of the diseases caused by non-pigmented rapidly growing mycobacteria in a University Hospital. Rev Esp Quimioter 2019; 32(5): 451-457.
16. Kumar C, Shrivastava K, Singh A, Chauhan V, Varma-Basi M. Skin and Soft-Tissue Infections Due to Rapidly Growing Mycobacteria: An Overview. Int J Mycobacteriol 2021;10(3):293-300. Doi: 10.4103/ijmy.ijmy_110_21.
17. Martínez-López AB, Álvarez-Blanco O, Ruíz Serrano MJ, Morales-San José MD, Luque de Pablos A. Mycobacterium fortuitum como causa de infección del orificio del catéter de diálisis peritoneal. Caso clínico y revisión de la literatura. Nefrologia 2015;35(6):582–590.
18. Sosa Campos LE, Silva Arellano AI, Rivera Martínez E. Infección por Mycobacterium fortuitum en cirugía plástica. Tratamiento exitoso con claritromicina y levofloxacino durante 12 semanas. Enf Inf Microbiol 2019; 39(4):123-128.
19. Patrón Ordoñez G, Llanos Tejada F, Benites Gamboa D, Espinoza Chiong C. Coinfección por Mycobacterium abscessus y Mycobacterium tuberculosis en un paciente con síndrome de Cushing exógeno y otras comorbilidades. Rev Peru Med Exp Salud Pública 2020;37(4):762-6. Doi: 10.17843/rpmesp.2020.374.5296
20. Büchler AC, Lazarevic V, Gaïa N et al. Mycobacterium chelonae Infection Identified by Metagenomic Next-Generation Sequencing as the Probable Cause of Acute Contained Rupture of a Biological Composite Graft—A Case Report. Int J Mol Sci 2021;23(1):381. Doi: 10.3390/ijms23010381.
21. Sardiñas Aragón M, Mederos Cuervo LM, García León G, Martínez Romero MR, Lemus Molina D, Díaz Rodríguez R. Identificación rápida de Micobacterias no tuberculosas en Cuba por las técnicas GenoType Mycobacterium CM/AS. Neumol Cir Torax 2019; 78 (3): 290-295. Doi: 10.35366/NT193E.
22. Sardiñas Aragón M, Mederos Cuervo LM, García León G, Martínez Romero MR. Identificación rápida del Complejo Mycobacterium avium a partir de aislados utilizando Genotype Mycobacterium CM. Convención de Salud 2022. [Internet]. [Consultado 15 Mar 2023]. Disponible en: https://convencionsalud.sld.cu
23. Mederos LM, Sardiñas M, García G, Martínez MR, Díaz R. Identificación de especies micobacterianas ambientales u oportunistas en pacientes sintomáticos y con VIH/sida. Salud (i) Ciencia 2020; 24:12-18.
24. Costa-Alcalde JJ, Barbeito-Castiñeiras G, González-Alba JM, Aguilera A, Galán JC, Pérez-del-Molino ML. Comparative evaluation of the identification of rapidly growing non-tuberculous mycobacteria by mass spectrometry (MALDI-TOF MS), GenoType Mycobacterium CM/AS assay and partial sequencing of the rpoβ gene with phylogenetic analysis as a reference method. Enferm Infecc Microbiol Clin (Engl Ed) 2019; 37(3):160-166. Doi: 10.1016/j.eimc.2018.04.012.