

REVISIÓN | Respirar, 2023; 15(4): 263-278 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.15.4.5
Recibido:
6 abril 2023
Aprobado:
29 junio 2023
Eduardo Borsini
https://orcid.org/0000-0003-2930-6022
Agustín Montes Onganía
https://orcid.org/0000-0002-5437-0715
Mariano De Muria
https://orcid.org/0000-0002-8861-3279
Bárbara Finn
https://orcid.org/0009-0003-0539-2103
Rafael Golpe
https://orcid.org/0000-0002-3759-5322
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
Abordaje paliativo en enfermedades respiratorias avanzadas
Palliative Approach in Advanced Respiratory Diseases
Eduardo Borsini1 , Agustín Montes Onganía2
, Agustín Montes Onganía2 , Mariano De Muria2
, Mariano De Muria2 ,
,
Bárbara Finn2 , Rafael Golpe3
, Rafael Golpe3
1. Hospital Británico, Servicio de Neumonología, Buenos Aires, Argentina.
2. Hospital Británico, Servicio de Clínica Médica, Programa de Cuidados Paliativos, Buenos Aires, Argentina.
3. Complejo Hospitalario Universitario de Lugo, Hospital Lucus Augusti, Servicio de Neumología, Galicia, España.
Autor CORRESPONSAL:
Eduardo Borsini, eborsini@hbritanico.com.ar
Resumen
Las enfermedades respiratorias crónicas avanzadas son prevalentes y producen deterioro de la calidad de vida, en particular la enfermedad pulmonar obstructiva crónica (EPOC), las enfermedades pulmonares intersticiales difusas (EPID) y las enfermedades neuromusculares progresivas con compromiso diafragmático (ENM).
Quienes las padecen presentan síntomas persistentes que no son siempre adecuadamente controlados por los tratamientos recomendados por las guías clínicas de manejo. El tratamiento paliativo de los síntomas persistentes es un punto relevante y suelen presentarse barreras para su implementación.
Este artículo ofrece una revisión narrativa sobre una perspectiva latinoamericana acerca del rol de los cuidados paliativos en enfermedades respiratorias avanzadas.
Palabras clave: enfermedad pulmonar obstructiva crónica, enfermedades neuromusculares, enfermedad pulmonar intersticial, cuidados paliativos.
Abstract
Advanced chronic respiratory diseases are prevalent and cause deterioration in quality of life, particularly chronic obstructive pulmonary disease (COPD), diffuse interstitial lung diseases (ILD) and progressive neuromuscular diseases with diaphragmatic involvement (NMD).
Those who suffer from them usually present persistent symptoms that are not always adequately controlled by the treatments recommended by the clinical management guidelines. Palliative treatment of persistent symptoms is a relevant point, but the palliative approach usually presents barriers to its implementation.
This article offers a narrative review over Latin American perspective on the role of palliative care in advanced respiratory diseases.
Key words: chronic obstructive pulmonary disease, neuromuscular diseases, interstitial lung diseases, palliative care.
Introducción
“Le temo a los médicos que solo saben de medicina”
Francisco “Paco” Maglio
La atención paliativa (AP) es la asistencia activa y holística de personas con sufrimiento grave debido a enfermedad severa, especialmente cerca del final de la vida, con el objetivo de mejorar su calidad de vida, la de sus familias y cuidadores.1
La calidad de vida podría entenderse como la brecha entre las expectativas individuales y la realidad existencial en un momento determinado.
La AP presenta las siguientes características: 1) considera a la muerte un proceso normal y no intenta acelerarla ni retrasarla, 2) ofrece soporte para ayudar a los pacientes a vivir tan activamente como sea posible, 3) facilita la adaptación de los familiares a la enfermedad y al duelo tras el fallecimiento de sus seres queridos, 4) intenta mejorar la calidad de vida, 5) proporciona educación sobre la enfermedad y los tratamientos posibles, 6) colabora con los médicos de cabecera con el objetivo de aliviar el sufrimiento prevenible y unificar los esfuerzos con objetivos diferentes a la curación, 7) utiliza el trabajo en equipo y debe implementarse de forma precoz conjuntamente con tratamientos orientados a prolongar la vida.2
La AP se inició en unidades oncológicas, aunque existe evidencia que sustenta el abordaje paliativo precoz en el cáncer3 y en las enfermedades respiratorias crónicas avanzadas4 (ERCA).
A diferencia de los pacientes oncológicos, en los que la evolución presenta un curso relativamente predecible, en las ERCA el curso es difícil de anticipar (figura 1) y suele asociarse a episodios de agudización5 (“evolución en crisis”), cada uno de los cuales puede provocar la muerte. Durante estas crisis, su funcionalidad se deteriora rápidamente, con una mejoría posterior muchas veces incompleta, a menudo con una fase terminal diferenciable.5 (Figura 1).
En la Ciudad de Buenos Aires, un tercio de los pacientes relevados mediante el instrumento NECPAL CCOMS-ICO cumplían la definición de enfermedad crónica avanzada.6 La AP en las ERCA ha debido adaptarse para iniciarse precozmente, basándose en las necesidades del paciente más que en su pronóstico vital (Tabla 1).
Figura 1.
Modelos de trayectoria vital (modificado de Cohen-Mansfield et al.5)
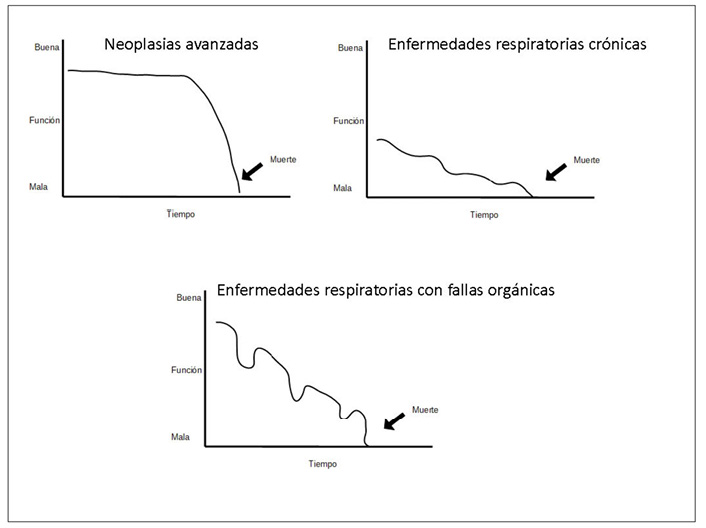
Tabla 1.
Esquema de los distintos tipos de cuidados sanitarios.
|
Modelo de atención |
Características |
Objetivos |
Ejemplo |
|
Centrada en el profesional |
Habilidades clínicas |
Diagnóstico |
Labor de especialistas |
|
Medicina basada en la experiencia |
Cirugía |
||
|
Medicina basada en la evidencia |
Procedimientos |
||
|
Centrada en los recursos |
Medicina basada en la evidencia Medicina basada en la eficiencia Costo-efectividad |
Gestión clínica |
Medicina sanitaria |
|
Centrada en el paciente y su familia |
Comunicación Confianza y seguridad Trato interpersonal Medicina basada en la autonomía Decisiones basadas en las preferencias y las creencias |
Alivio sintomático sufrimiento físico, psicológico y espiritual |
Medicina paliativa |
La organización mundial de la salud (OMS), en el año 2014 y mediante una resolución global dirigida a sus países miembros (67° Asamblea Mundial de la Salud),7 exhortó a que se formulen y apliquen políticas de cuidados paliativos en todos los niveles de atención con programas de cobertura universal. Algunos países han desarrollado políticas en este sentido como, por ejemplo, España (Plan Nacional de Cuidado Paliativos, Observatorio Qualy de final de vida de Catalunya, Centro Colaborador OMS [CCOMS] para programas públicos de cuidados paliativos), Estados Unidos (National Hospice and Palliative Care Organization, International Association for Hospice and Palliative Care), Canadá (Palliative Coverage Program), India (National Coverage Palliative Care), Argentina (Programa Nacional de Cuidados Paliativos).
Identificación del paciente respiratorio candidato a recibir atención paliativa
Algunos estudios han demostrado que la intervención paliativa precoz en cáncer mejora la calidad de vida y reduce la hospitalización.3,8 La Sociedad Americana de Oncología Clínica propuso criterios para identificar candidatos para AP.9 (Tabla 2). Estos criterios toman en cuenta la pregunta “sorpresa”: ¿le sorprendería que este paciente falleciese en los próximos 12 meses? En caso de respuesta negativa, la complejidad e intensidad de los cuidados, el deterioro funcional y el consumo de recursos orientan a plantear la inclusión en un programa de AP.
Tabla 2.
Criterios para derivación a un programa de atención paliativa de la Sociedad Americana de Oncología Clínica (simplificado).
|
Primarios |
|
Pregunta sorpresa: ¿le sorprendería que este paciente falleciese en los próximos 12 meses? |
|
Internaciones frecuentes (> 1 hospitalización por la misma condición) |
|
Ingreso debido a necesidad de controlar síntomas físicos o malestar emocional |
|
Cuidados complejos (dependencia funcional, gastrostomía, ventilación mecánica domiciliaria…) |
|
Deterioro funcional, intolerancia alimentaria, pérdida de peso |
|
Secundarios |
|
Internación en centros sanitarios |
|
Ancianos, deterioro cognitivo, fractura de cadera |
|
Cáncer metastásico o localmente avanzado incurable |
|
Necesidad de oxigenoterapia crónica |
|
Paro cardíaco fuera del hospital |
|
Inclusión previa en un programa de atención domiciliaria |
|
Soporte social limitado |
|
Ausencia de un documento o discusión previa de planificación anticipada de cuidados |
Es interesante reflexionar acerca de que cuando se plantea la pregunta sorpresa de manera inversa, a menudo tiene un resultado diferente; ¿le sorprendería que este paciente siguiera vivo dentro de 12 meses?
En todos los pacientes con ERCA debe realizarse la planificación anticipada de cuidados, dialogando sobre objetivos y preferencias acerca de futuros tratamientos, incluyendo situaciones en que se pierda la capacidad para comunicar sus preferencias.
Se han acuñado los términos; “primera transición” y “segunda transición” para diseñar un plan de AP. La primera transición es la identificación de la oportunidad de intervenir, es decir, identificar aquellos con expectativa de vida limitada y elevada carga sintomática en los que es preciso reorientar los objetivos terapéuticos.9-13
El NECPAL, validado en Argentina, identifica enfermos en primera transición6 y predice mortalidad en hospitalizaciones a 12 y 24 meses (Tabla 3).14-15 Si bien, Argentina se encuentra dentro de los países de la región con mayor desarrollo de AP,14 sólo el ١٠٪ de los pacientes con estas necesidades la reciben.
Tabla 3.
Instrumento NECPAL CCOMS-ICO© (dentro del apartado 4, se incluyen solo los indicadores clínicos correspondientes a enfermedad pulmonar crónica, omitiendo los de otras patologías). Cualquier persona con pregunta sorpresa (bloque 1) positiva (respuesta «no») y al menos otro bloque (2, 3 o 4) positivo se consideraría en situación de enfermedad avanzada o terminal
|
1. Pregunta sorpresa |
|
|
¿Le sorprendería que este paciente falleciese en los próximos 12 meses? |
NO - Sí |
|
2. Elección / demanda o necesidad |
|
|
Elección/demanda: ¿el paciente con enfermedad avanzada o su cuidador principal han solicitado, explícita o implícitamente, la realización de tratamientos paliativos/de confort de forma exclusiva, proponen limitación del esfuerzo terapéutico o rechazan tratamientos específicos con intención curativa? |
S Í - No |
|
Necesidad: ¿considera que este paciente requiere actualmente tratamientos paliativos? |
SÍ - No |
|
3. Indicadores clínicos generales de gravedad y progresión |
|
|
Marcadores nutricionales: (cualquiera de los siguientes en los últimos 6 meses) |
SÍ - No |
|
- Gravedad: albúmina sérica < 2.5 g/dl no relacionado con descompensación aguda |
|
|
- Progresión: pérdida de peso > 10% |
|
|
- Impresión clínica de deterioro nutricional o ponderal sostenido, intenso/ grave, progresivo, irreversible y no relacionado con proceso intercurrente |
|
|
Marcadores funcionales: (cualquiera de los siguientes en los últimos 6 meses) |
SÍ - No |
|
- Gravedad: dependencia funcional grave establecida (Barthel < 25, ECOG > 2 o Karnofsky < 50% |
|
|
- Progresión: pérdida de 2 ó más actividades básicas de la vida diaria a pesar de intervención terapéutica adecuada |
|
|
- Impresión clínica de deterioro funcional sostenido, intenso/ grave, progresivo, irreversible y no relacionado con proceso intercurrente |
|
|
Otros marcadores de gravedad y fragilidad extremas (2 de los siguientes en últimos 6 meses): |
SÍ - No |
|
- Úlceras por decúbito persistentes (estadio III – IV) |
|
|
- Infecciones de repetición con repercusión sistémica (> 1) |
|
|
- Síndrome confusional agudo |
|
|
- Disfagia persistente |
|
|
- Caídas (> 2 episodios) |
|
|
Presencia de distrés emocional con síntomas psicológicos sostenidos intensos/ graves, progresivos y no relacionados con proceso intercurrente agudo |
SÍ - No |
|
Factores adicionales de uso de recursos. Cualquiera de los siguientes: |
SÍ - No |
|
- 2 o más internaciones no programadas en centros hospitalarios o sociosanitarios por enfermedad crónica en el último año |
|
|
- Necesidad de cuidados complejos continuados, en una institución o en domicilio |
|
|
Comorbilidad: ≥ patologías concomitantes |
SÍ - No |
|
4. Indicadores clínicos específicos de gravedad y progresión por patologías (enfermedad pulmonar crónica). |
|
|
- Disnea de reposo o de mínimos esfuerzos entre exacerbaciones |
SÍ - No |
|
- Síntomas físicos o psicológicos de difícil manejo, con tratamiento óptimo bien tolerado |
|
|
- En caso de disponer de pruebas funcionales respiratorias con criterio de calidad: VEF1 < 30%, o CVF < 40% o DLCO < 40% |
|
|
- Cumplimiento de criterios de oxigenoterapia domiciliaria (o estar actualmente recibiéndola) |
|
|
- Insuficiencia cardíaca sintomática |
|
|
- Hospitalizaciones recurrentes (> 3 en 12 meses por exacerbación de EPOC) |
|
ECOG: Eastern Cooperative Oncology Group. VEF1: Volumen espiratorio forzado en el 1° segundo. CVF: Capacidad vital forzada. DLCO: difusión de monóxido de carbono. EPOC: enfermedad pulmonar obstructiva crónica.
La segunda transición es un segundo punto de inflexión, en el cual el paciente ingresa en la fase final e irreversible de su trayectoria de vida.
En la EPOC, se han estudiado variables como la magnitud de obstrucción al flujo aéreo, la escasa actividad física, grados avanzados de disnea, bajo índice de masa corporal o consumo de recursos sanitarios, para predecir pronóstico vital.11,12 Estas variables se han integrado en índices multidimensionales (BODE, BODEx, CODEX, HADO), pero su utilidad para predecir supervivencia es limitada.12, 15-18
La dificultad para estimar el pronóstico no debe demorar el inicio de la AP ya que estos pacientes presentan comorbilidades, fragilidad y múltiples síntomas de la esfera física y psicológica.15-20 En pacientes con EPID existe todavía más incertidumbre.21
Algunas situaciones como las hospitalizaciones frecuentes (sobre todo cuando son no programadas y requieren soporte respiratorio complejo) y el impacto funcional de la enfermedad deben plantear la oportunidad del inicio de la planificación anticipada de los cuidados y la AP.22 (Tabla 4). Muchas veces este enfoque no se ofrece salvo a solicitud del propio paciente ya que existen barreras atribuibles al paciente, al médico o al sistema sanitario, así como elementos que pueden facilitarla. (Tabla 5).
Tabla 4.
Puntos de transición en la EPOC que pueden llevar al inicio de la Planificación Anticipada de los Cuidados (modificado de Tavares et al.19).
|
1. |
Episodios recurrentes de exacerbaciones |
|
2. |
Internaciones frecuentes para el manejo de síntomas |
|
3. |
Oxigenoterapia domiciliaria |
|
4. |
Hipercapnia crónica |
|
5. |
Desarrollo de cor pulmonar |
|
6. |
Agudizaciones que requieren ventilación mecánica no invasiva |
|
7. |
Presencia de comorbilidades graves |
|
8. |
Pérdida de peso no planificada |
|
9. |
Disminución de la capacidad para participar en actividades recreativas |
|
10. |
Necesidad de ayuda para las actividades de la vida diaria |
|
11. |
Cambios en el entorno familiar, adaptación del domicilio o traslado a tercer nivel |
|
12. |
Solicitud del paciente o de un familiar |
|
13. |
Dificultad para mantener una actividad social normal |
Tabla 5.
Barreras y facilitadores para la atención paliativa.
|
Barreras |
||
|
Del paciente |
Del profesional sanitario |
Del sistema sanitario |
|
Conocimiento insuficiente de su enfermedad Aversión a considerar y discutir preferencias de tratamiento futuro Negación de la enfermedad y de la posibilidad de morir Centrar sus deseos y expectativas en la prolongación de la vida |
Renuencia a implicarse en la Planificación Anticipada de Cuidados Temor a producir desesperanza en el paciente Dificultad en establecer el pronóstico vital Conocimiento inadecuado del paciente Fallas en la comunicación de malas noticias |
Ausencia de un programa de atención paliativa estructurado Inexistencia de entrenamiento formal en comunicación para la Planificación Anticipada de Cuidados Falta de comunicación entre niveles asistenciales. Disgregación de la asistencia Tiempo de consulta inadecuado para discutir los temas con el paciente Falta de identificación de un responsable principal del cuidado |
|
Facilitadores |
||
|
Conocimiento de la naturaleza avanzada de su enfermedad Preocupación de convertirse en una carga para su familia Experiencia con familiares o amigos fallecidos por enfermedad Aceptación de la enfermedad Confianza en el equipo asistencial Disposición a discutir los cuidados de final de vida |
Experiencia con pacientes con enfermedad crónica avanzada Buena relación médico-paciente Interacción con paliativistas |
Adecuada continuidad de cuidados por el equipo asistencial |
Hay muchos aspectos a plantear como: la localización del lugar para la atención (domicilio del paciente o de un familiar, institucionalización, etc.), la modalidad de administración de cuidados en el final de la vida (atención en el hogar, internación domiciliaria, etc.), preferencias respecto del inicio y finalización del soporte vital (inicio o no de ventilación mecánica, abstención de medidas de soporte vital en caso de paro cardíaco, retirada de soporte en dependencia prolongada de ventilación mecánica, etc.).
Quienes asisten a estos pacientes deben estar entrenados en herramientas de comunicación dado que informar el pronóstico puede ser estresante para el paciente, sus familiares y para el propio médico.23 Existen protocolos diseñados para comunicar malas noticias.23-24 Antes de comunicar una mala noticia, se debe encontrar el momento y lugar adecuado y conocer el grado de información recibida previamente (indagando si el paciente desea recibir esta información), además de tener una planificación respecto al plan de cuidado para no generar incertidumbre.
El pedido de la familia de evitar dar información con intención de preservar la integridad psíquica del paciente no es argumento válido para no informar a quien desea ser informado.22-25
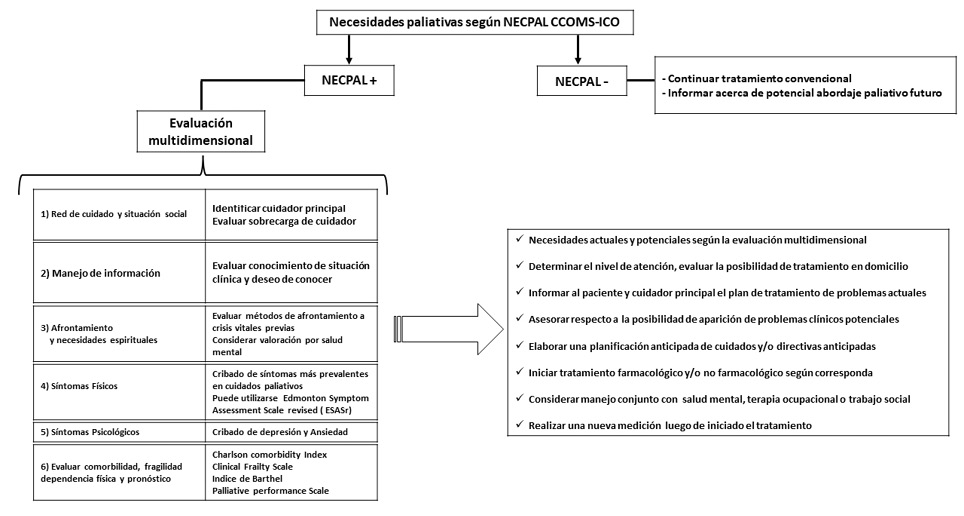
La figura 2 ilustra los puntos salientes para la identificación de candidatos, puesta en marcha y conducción de un programa de atención paliativa.
Figura 2.
Esquema con los puntos clave para la organización de la atención paliativa
Problemas clínicos frecuentes con un enfoque paliativo
El dolor y la disnea son síntomas frecuentes en neoplasias torácicas. Del 60 al 80% de los pacientes con cáncer sufren dolor moderado a grave, con distintos mecanismos (infiltración por el tumor, efecto de tratamientos, comorbilidades, etc.). En la evaluación del dolor deben tenerse en cuenta la causa y localización, su mecanismo fisiopatológico, el tiempo de evolución, la intensidad y el grado de interferencia en las actividades cotidianas. Es importante reconocer que la expresión del dolor de los pacientes excede al fenómeno nociceptivo puro, existiendo además una dimensión afectiva emocional y cognitiva.
La disnea es, sin duda, uno de los síntomas más frecuentes en las ERCA. Puede tener muchos mecanismos en el cáncer de pulmón; ser producida directamente por el tumor (derrame pleural, linfangitis carcinomatosa, obstrucción de vía aérea, ascitis, parálisis frénica), por complicaciones (embolia pulmonar, neumonía, anemia), producirse por los tratamientos oncológicos (neumonitis radiógena o por la quimioterapia) o debido a comorbilidades (EPOC, insuficiencia cardíaca).
La tos (etiopatogenia múltiple) puede estar relacionada con el tumor, los tratamientos o comorbilidades, y la hemoptisis se presenta hasta en el 20% de los pacientes con cáncer de pulmón. La anorexia, ansiedad, depresión y trastornos del sueño son también síntomas comunes.
Con respecto a ERCA no oncológicas, el paciente pasa por un proceso de adaptación que se ha descrito con varios modelos. El modelo circular de Stedeford modifica el clásico modelo lineal de Kübler-Ross,26 (incertidumbre – negación – ira – negociación – tristeza – aceptación); destaca que la transición no siempre es lineal ni completa y que es posible que el paciente regrese a etapas anteriores o pueda situarse en más de una fase al mismo tiempo.26
En la EPOC, la disnea y la tos suelen presentarse asociadas por lo que se las ha denominado “cluster respiratorio”.19-20 (Tabla 6). No hay relación entre la función pulmonar y la disnea, por lo que la mejoría de la función pulmonar no siempre garantiza un buen control sintomático. El grupo Cambridge Breathlessness Intervention Service ha desarrollado un modelo teórico “Respiración, pensamiento, funcionamiento” (“Breathing, Thinking, Functioning”) que se basa en tres reacciones cognitivas conductuales que empeoran y mantienen este síntoma.27
Tabla 6.
Problemas clínicos en atención paliativa en la EPOC (modificado de Maddocks et al.17).
|
Síntoma |
Manejo terapéutico |
|
Disnea |
Opioides Benzodiacepinas (papel limitado) Oxígeno Ventilación no invasiva Rehabilitación respiratoria Terapia cognitiva conductual Otros (cambios de hábitos, planificación de actividades...) |
|
Fatiga |
Rehabilitación respiratoria Programas de educación Higiene del sueño |
|
Tos |
Codeína Pregabalina o gabapentina Educación del habla y lenguaje |
|
Depresión |
Intervención cognitiva conductual Antidepresivos (inhibidores de recaptación de serotonina) Tratamiento psicológico |
|
Ansiedad |
Tratamiento psicológico Ansiolíticos |
|
Dolor |
Escasa evidencia. Principios de la escala analgésica de la OMS |
|
Anorexia |
Suplementos nutricionales si hay evidencia de malnutrición Acetato de megestrol |
|
Trastornos del sueño |
Adecuada higiene del sueño VNI o CPAP si hipercapnia crónica o AOS, respectivamente |
|
Disfunción sexual |
Educación, terapia de ejercicio, consejo sobre postura Tratamiento farmacológico |
OMS: Organización Mundial de la Salud. VNI: ventilación no invasiva. CPAP: presión continua positiva en vía aérea. AOS: apnea obstructiva durante el sueño.
El dolor crónico en la EPOC puede ser un síntoma prevalente, con una etiopatogenia compleja que puede incluir alteraciones en la mecánica respiratoria y musculoesquelética, fracturas por osteoporosis, alteraciones posturales y menor umbral por el estado inflamatorio asociado.28 Algunos estudios han encontrado que es más frecuente el dolor en EPOC avanzado que en el cáncer. No se ha encontrado aumento de efectos adversos respiratorios en EPOC tratados con dosis bajas de morfina durante 4 semanas.29
En ENM, la debilidad de los músculos inspiratorios puede producir disnea como síntoma cardinal e hipoventilación como principal complicación. Cuando la debilidad respiratoria interfiere con el sueño o la capacidad vital forzada (CVF) disminuye < 50%, la mayoría de los expertos sugieren iniciar ventilación con presión positiva no invasiva (VNI). Bach30 y autores referentes31 recomiendan mantenerla hasta que se presente fracaso severo en la musculatura bulbar y el paciente pierde la capacidad de hablar, tragar y proteger las vías respiratorias. En ese punto, la traqueostomía se vuelve necesaria para la supervivencia, aunque es el paciente quien debe decidir esta opción.
La tos y la dificultad para eliminar las secreciones son síntomas crónicos y causas de hospitalización en ENM. La tos asistida (manual o instrumental) con “apilamiento de aire” (Air Stacking), compresión manual e insuflaciones con bolsa-máscara, así como dispositivos mecánicos de asistencia de la tos mejoran estos síntomas, que de otra manera se tornan refractarios.30-31
Existe consenso en ENM de curso rápidamente progresivo acerca de cuándo iniciar una discusión sobre temas relacionados con el final de la vida:31 1) el paciente o la familia pide recibir información sobre intervenciones al final de la vida (inducida o espontánea, verbal o no verbal); 2) angustia psicológica, social o espiritual grave o sufrimiento existencial; 3) dolor que requiere altas dosis de analgésicos; 4) disfagia que requiere sonda o alimentación por gastrostomía; 5) disnea o síntomas de hipoventilación o una CVF < 50% y 6) pérdida de función en dos regiones (bulbar, brazos y piernas). En ENM lentamente progresivas, los criterios podrían adaptarse, aunque la estimación de la trayectoria vital en base a CVF y el uso de VNI es inexacta.
Tratamiento farmacológico
Disnea
Los opioides son el tratamiento básico de la disnea en el paciente oncológico, una vez que se han descartado causas tratables (ej.: derrame pleural). Constituyen asimismo un tratamiento aceptado para la disnea refractaria en EPOC, EPID y ENM en fase avanzada, con síntomas refractarios.
La morfina es el fármaco más utilizado.32 Hay poca evidencia con fentanilo en EPOC33 y por vía oral transmucosa (por su rapidez de acción) para tratar la disnea en cánceres avanzados.32 La vía de administración oral es la preferida, pudiendo emplearse la vía subcutánea o intravenosa en casos especiales.32
En la EPOC, podría comenzarse por dosis bajas (ej.: dosis inicial de 1-2 mg/día de morfina de liberación rápida o 5 mg cada 12 horas de liberación prolongada).28,29,32.
La pauta dependerá de la situación clínica (ambulatoria u hospitalaria) y el riesgo de efectos adversos respiratorios. Pueden emplearse rescates si persisten episodios de disnea que no ceden con medidas no farmacológicas. Los efectos secundarios más frecuentes son la somnolencia, náuseas, vómitos y constipación. La mirtazapina ha sido utilizada para la disnea en ERCA y ha demostrado mejoría a los 28 días sin diferencias en tolerancia y seguridad.34 Las benzodiacepinas, el oxígeno en ausencia de hipoxemia y los cannabinoides no han demostrado beneficio en EPOC.28,29,35
Tos
Limita la calidad de vida y en las EPID puede ser prevalente al punto de convertirse en la mayor causa de disconfort. Es importante buscar y tratar las causas desencadenantes (infecciones, reflujo gastroesofágico, rinitis/sinusitis, drogas, etc.).
En EPOC, EPID o pacientes con lesiones estructurales, si interfiere con el sueño, hay que considerar el empleo de codeína (15 mg a dosis creciente hasta un máximo de 60 mg/6 hs). Algunos estudios han demostrado un efecto beneficioso de gabapentina o pregabalina, iniciando con dosis bajas (75 mg/día) y aumentando según respuesta/tolerancia hasta 300 mg/día.36-37 El enfoque del manejo de la tos en ENM es diferente ya que apunta a mejorar la capacidad tusígena30-31 mediante fisioterapia activa regular y técnicas de asistencia de la tos.
Depresión y ansiedad
Representan problemas relevantes en neoplasias, ENM, EPOC y EPID avanzadas.
Los cuestionarios empleados en la identificación de la ansiedad incluyen síntomas somáticos (disnea o fatiga), por lo que se puede sobreestimar su prevalencia.
Aunque hay un vínculo entre la disnea y la ansiedad, no hay buena correlación entre la magnitud de una y otra, ni entre el grado de disminución de la disnea con intervenciones específicas y la magnitud de reducción en la ansiedad. Las intervenciones psicoterapéuticas se consideran tratamientos de primera línea en pacientes con ERCA. La rehabilitación respiratoria ha demostrado efectos beneficiosos en este sentido.
Los antidepresivos inhibidores selectivos de la recaptación de serotonina e inhibidores de la recaptación de serotonina y adrenalina suelen elegirse como primera opción en el paciente con cáncer o EPOC, por un menor riesgo de efectos adversos, aunque existen controversias38 sobre su seguridad.
Dolor
Se debe intentar identificar y tratar la causa siguiendo los principios de la escala analgésica de la OMS, cuyos fundamentos son el empleo de forma pautada (en lugar de solo “a demanda”), su administración por vía oral, preferentemente, escalando de forma progresiva desde analgésicos no opioides, seguidos de opioides débiles (codeína o tramadol) y opioides fuertes (morfina, fentanilo, buprenorfina, oxicodona o metadona) o pautas combinadas. La vía oral es preferible. Cuando sea precisa la administración parenteral, la vía subcutánea es preferible a la intravenosa, mientras que esta última es recomendable cuando sea necesario un inicio de acción rápido. Las vías transnasal y oral transmucosa suelen emplearse para el dolor irruptivo. La vía transdérmica (parches de fentanilo o buprenorfina) es útil cuando hay intolerancia oral.
Anorexia
La pérdida de peso en la EPOC avanzada suele presentarse y se ha especulado sobre sus mecanismos, entre los cuales la anorexia puede jugar un papel central. Por otra parte, en las ENM con compromiso bulbar es frecuente, por lo que la adecuación de la dieta (procesados, pautas de alimentación asistida, colaciones de alto valor proteico, plan de asistencia fonoaudiológica, etc.) deben ser ofrecidas en etapas tempranas, particularmente cuando la disfunción de músculos del cuello y bulbares comienza a observarse clínicamente. En esta población, una CVF de < 50%, fallo ventilatorio y VNI o estudios de deglución con evidencia de penetración del alimento a las vías aéreas sugieren el uso de vías alternativas de alimentación.
La alimentación por sonda o gastrostomía puede ser suplementaria a la vía oral asistida, lo que permite que en las primeras fases el paciente mantenga el contacto con los alimentos y pueda saborearlos y olerlos. La alimentación suplementaria sólo ha sido demostrada como beneficiosa en pacientes con malnutrición.39
En pacientes con VNI y trayectoria vital > 6 meses, se prefiere la gastrostomía (pasible de realizarse por vía percutánea) debido a la facilidad para su manejo en el domicilio, liberando el rostro y facilitando la VNI, la asistencia de la tos, la kinesioterapia y la comunicación.
Algunos estudios han valorado los anabólicos androgénicos o progestágenos estimulantes del apetito como acetato de megestrol.40 Los corticosteroides pueden tener efecto anti-anorexígeno, pero este se pierde en pocas semanas y los efectos secundarios son significativos (considerarse en expectativa de supervivencia < 1 mes).
Tratamiento no farmacológico
Las neoplasias torácicas pueden asociarse a complicaciones derivadas de la invasión de estructuras del tórax, algunas de las cuales no pueden resolverse con intervención quirúrgica, no responden a quimioterapia o radioterapia y precisan tratamientos no farmacológicos con intención paliativa.
La obstrucción de la vía aérea central puede tratarse con broncoscopia rígida, láser, stent o prótesis endobronquiales, braquiterapia, crioterapia, etc. El empleo por vía broncoscópica de láser o electrocoagulación son útiles para la hemoptisis neoplásica. Las fístulas traqueoesofágicas pueden tratarse con prótesis endotraqueales y algunos casos de síndrome de vena cava superior precisan prótesis endovasculares. Por otra parte, el derrame pleural sintomático puede tratarse con drenaje simple, catéteres tunelizados, pleurodésis mínimamente invasiva, shunt pleuroperitoneal, etc., dependiendo de la situación clínica y la sobrevida esperada.
La rehabilitación respiratoria es importante para la disnea que persiste tras optimizar el tratamiento farmacológico ya que el deacondicionamiento y debilidad muscular (con o sin sarcopenia) juegan un papel relevante en ENM y EPOC.
Existen escasos estudios sobre rehabilitación respiratoria en EPID,41 en general, pequeños y heterogéneos, pero han demostrado mejorías en síntomas y capacidad de esfuerzo. Estos pacientes presentan intolerancia al ejercicio y mayor desaturación de oxígeno que los EPOC, lo que hace más compleja la rehabilitación.
Algunos pacientes con EPOC son incapaces de participar en un programa de entrenamiento y en estos casos se ha propuesto la estimulación neuromuscular eléctrica (particularmente del cuádriceps) como una alternativa.42
Los objetivos de la rehabilitación en ENM son diferentes; evitar las posturas viciosas y atrofia muscular por desuso, mantener la movilidad articular y facilitar el funcionamiento muscular de los grupos preservados sin alcanzar el umbral de fatiga.
Existe confusión en la comunidad médica y entre los pacientes respecto de la oxigenoterapia como tratamiento paliativo de la disnea (a menudo demandada por los pacientes). Ensayos clínicos aleatorizados y controlados con placebo (aire comprimido) en EPOC y cáncer no han demostrado efecto beneficioso en pacientes normoxémicos.43 Por ello, la oxigenoterapia domiciliaria debería reservarse para hipoxemia en rango de insuficiencia respiratoria de modo que se consiga una saturación de O2 > 90%, sin retardar otras medidas eficaces para el control de la disnea.
Las indicaciones de la VNI en la insuficiencia respiratoria crónica en la EPOC están en evolución, pero su empleo con finalidad paliativa en ERCA ofrece controversias. 44 Su utilización puede considerarse, si consigue mejorar la disnea y calidad de vida, con un mínimo de efectos adversos.45
Algunos enfermos con hipercapnia presentan somnolencia que puede interferir en su calidad de vida y la VNI puede resultar beneficiosa y permitir el regreso al domicilio o prolongar su supervivencia hasta despedirse de sus seres queridos. Puede plantearse con el objetivo de alargar la vida (resolución de exacerbaciones) en pacientes que han rechazado medidas más agresivas. Los objetivos y límites de la VNI deben discutirse con el paciente y su familia, y consensuarse el momento de finalizarlo (Ej: falta de mejoría de la disnea, intolerancias, deterioro clínico). En una situación de final de vida solo tendrá sentido su empleo si contribuye a aliviar la situación del paciente sin efectos adversos (principio de no maleficencia). Carece de sentido en este escenario, en pacientes con disminución del nivel de conciencia.45 (Tabla 7).
Tabla 7.
Recomendaciones para suspender la VNI en la atención paliativa (modificado de Tripodoro et al.42).
|
Situaciones en las que no se debe utilizar VNI en el contexto de los cuidados paliativos |
|
Deformidad o lesión facial que no permite el apoyo de una máscara cómoda |
|
Cuando la VNI no logra aliviar la disnea |
|
Cuando el paciente pierde la conciencia o se muestra desconectado del entorno |
|
Cuando el paciente quiere comunicarse con sus seres queridos en el contexto de los cuidados del fin de vida |
En EPID no existen estudios sobre el efecto de la VNI en la disnea, por lo cual no se recomienda. Pese a ello, un estudio retrospectivo revela que se ofrece con frecuencia en pacientes con EPID en situación de final de vida.46 La oxigenoterapia con cánula de alto flujo es una modalidad novedosa con ventajas teóricas sobre la VNI en el contexto de AP (menos sensación de claustrofobia y lesiones cutáneas), pero su papel todavía no está completamente comprendido.44
Los cuidadores
Los cuidadores informales (personal no sanitario a cargo de la asistencia) son en extremo importantes para el manejo de las ERCA. Estos cuidadores asisten al paciente en sus actividades diarias, lo ayudan con la toma de la medicación y tratamiento no farmacológicos (VNI, oxígeno etc.), lo acompañan a las consultas médicas y le proporcionan soporte emocional y compañía.
Los efectos positivos del cuidador sobre el paciente son evidentes. Mejoran su calidad de vida, reducen la ansiedad, aumentan la adherencia a las medidas terapéuticas (abandono del tabaquismo, pautas de alimentación, etc.), reducen el consumo de recursos hospitalarios y pueden disminuir los costos. Sin embargo, la relación entre el paciente, su cuidador y el personal sanitario es compleja, y no todas sus consecuencias son positivas.33 Se han identificado consecuencias negativas de esta relación (sobreprotección), lo que reduce la autonomía del paciente. 30-31
El cuidador también experimenta consecuencias de la relación con el paciente y su enfermedad; puede sufrir ansiedad y depresión, reducir sus actividades de ocio, alterar su vida laboral y experimentar aislamiento social. Algunos trabajos sugieren el abordaje sistemático de estos síntomas en los cuidadores principales y en convivientes de pacientes con EPOC avanzado.47, 48
Un estudio realizado en Suecia, interviniendo mediante entrevistas pautadas con familias de pacientes con EPOC en fase avanzada, puso en evidencia que el principal problema identificado fue la ambigüedad entre las recomendaciones de cuidado y la falta de previsión en actividades que ayudasen con las dudas y el sufrimiento de los cuidadores. La ambigüedad impide solicitar ayuda y acceder a la provisión de apoyo emocional, práctico e información clara, en relación con sus funciones y expectativas. Tanto los cuidadores como el personal sanitario describieron experiencias positivas de diálogo. El diálogo puede facilitar los medios para ayudar a los cuidadores y parece ser un apoyo en sí mismo.49
En ocasiones, el paciente y el cuidador tienen percepciones discrepantes de la gravedad de los síntomas y el estado de salud del enfermo, lo que puede tensionar la relación y deteriorar la calidad de vida de ambos. Este desacuerdo puede extenderse al médico, muchas veces facilitado por diferencias de opinión entre especialistas o ausencia de médico de cabecera. En nuestro medio, la ausencia de programas de asistencia para los cuidadores es frecuente (cuidar a los que cuidan). La planificación de la asistencia con participación de los cuidadores reduce su ansiedad /depresión y el impacto de su duelo.31, 49
Atención en el final de la vida
La última parte de la trayectoria de vida en las ERCA es una fase irreversible en que la muerte es inminente. Por lo general los pacientes no fallecen súbitamente y el empeoramiento de la disnea y la ansiedad en ese periodo son difíciles de manejar para los cuidadores y familiares, incluso en las mejores circunstancias.
Un elemento importante es la planificación del lugar de la muerte, puesto que varios estudios han encontrado que una proporción importante de pacientes fallecen en un lugar distinto al que habían elegido, y que la proporción de EPOC que fallece en su domicilio es inferior a la de los pacientes con cáncer.
La muerte en el hospital disminuye la sobrecarga a los cuidadores y puede proporcionar seguridad respecto a la calidad de las medidas paliativas, mientras que fallecer en el domicilio favorece el acompañamiento del paciente, lo sitúa en un entorno familiar y amigable, y reduce el riesgo de ensañamiento terapéutico.
Un área de gran interés en la investigación en AP radica en la medición de la calidad de la atención en la fase final de la vida. Se han diseñado diversos instrumentos, pero vale la pena mencionar el “Care of the Dying Evaluation (CODE)” por sus propiedades psicométricas y por haberse validado en nuestro país, que consiste en un cuestionario diseñado para familiares en periodo de duelo.50-52
En un estudio reciente conducido en Noruega y Argentina52 mediante el CODE, se evidenció que familiares incluidos en la planificación de las decisiones tenían mejor percepción de la atención en el final de vida. Este dato ilustra el deseo de pacientes y familias de ser informados y participar en las decisiones de los últimos días.
La situación de últimos días y su comunicación a la familia debe ser informada por el equipo que habitualmente lo asiste, evitando información contradictoria.53
En caso de que a pesar de los tratamientos paliativos para el abordaje de los síntomas físicos, psíquicos o espirituales no pueda lograrse un adecuado alivio del sufrimiento puede ser necesaria la sedación paliativa cuyo objetivo es el alivio de síntomas persistentes mediante la dosis mínima suficiente, sin buscar adelantar la muerte.54
Deben evitarse las maniobras molestas y poco eficaces (sondaje vesical, accesos venosos innecesarios, aspiración de secreciones, etc.). En este punto, pierden relevancia el control de signos vitales, el monitoreo o las alarmas de los ventiladores. Se debe ofrecer apoyo psicológico y espiritual al paciente y su familia.
No hay pautas consensuadas de sedación en las ENM, la EPOC o en la EPID. Lo más habitual es una combinación de morfina y midazolam.
El midazolam puede administrarse por vía subcutánea o endovenosa. Por vía subcutánea la dosis de inducción es de 2,5 a 5 mg. Esta dosis puede repetirse las veces que se requiera hasta alcanzar la sedación. Si se emplea midazolam i.v. se sugieren dosis iniciales de 1,5 a 3 mg hasta lograr el nivel de sedación deseada.54 Adicionalmente, debe mantenerse siempre el tratamiento con morfina, en general, empleando la dosis que se venía empleando para controlar disnea y dolor.
Aspectos legales de la adecuación del esfuerzo terapéutico en Argentina
El paciente tiene derecho a recibir información respecto a su diagnóstico y pronóstico. Se debe evitar el paternalismo o la subestimación de su capacidad de comprensión ya que únicamente cuando comprenda exactamente su situación podrá decidir sobre los tratamientos y cuidados que no desea recibir. Esta información debe proporcionarse al paciente, no exclusivamente a sus familiares, salvo que por su situación de fragilidad no pueda interpretarla o que haya solicitado no recibirla.55
Durante el año 2011 se inició en la Argentina un profundo debate acerca del morir con dignidad. Así, el Congreso de la Nación Argentina sancionó la Ley n° 26742, conocida como “ley de muerte digna” que modificó la Ley sobre “Derechos del Paciente en su relación con los Profesionales e Instituciones de la Salud”. Estas modificaciones expresan el privilegio que posee la autonomía de la voluntad en nuestro orden jurídico.56
Morir con dignidad implica reservar para el paciente, sus familiares o representantes legales la decisión acerca de los tratamientos o de su interrupción cuando ya se ha iniciado, incluso cuando esto signifique debilitar o extinguir la vida. En otras palabras, es un derecho a transitar con dignidad los últimos instantes de la vida. Esta ley explicita el derecho a rechazar tratamientos médicos cuando resulten “extraordinarios o desproporcionados” en relación con la perspectiva de mejoría o cuando causen un sufrimiento desmesurado en “enfermedad irreversible, incurable o en estadio terminal”.
No implica una práctica eutanásica (procurar la muerte de otra persona impulsado por la piedad) ya que en Argentina es considerada ilegal55-56 (artículo 60 del Código Civil y artículo 11 de la Ley de Derechos del Paciente). El reconocimiento de futilidad (tratamiento médico considerado inútil por su baja probabilidad de aportar beneficio) debe ser la idea rectora primordial ya que el médico solo está obligado a no dañar.
El paciente tiene derecho de revocar su decisión en cualquier momento sin una mediación legal con actores formales del sistema jurídico, siendo suficiente la adecuada documentación en la historia clínica.
En julio de 2022 se promulgó la ley 27.678 que busca promover el acceso a la AP (terapias farmacológicas y no farmacológicas) basadas en evidencia científica, facilitar el acceso a fármacos esenciales en AP,57 promover equipos multidisciplinarios, la formación profesional y la investigación en este tipo de cuidados.
Comentarios finales
Los cuidados paliativos en enfermedades respiratorias a menudo progresivas e incurables tienen hoy un papel importante en el alivio del sufrimiento físico y existencial. El rol del equipo sanitario con frecuencia debe orientarse de acuerdo a cada etapa de la enfermedad, como propuso el médico francés Adolphe Gubler (1821-1879); “curar a veces, aliviar a menudo, consolar siempre”.58
Financiamiento: los autores declaran que el trabajo no tuvo financiamiento.
Conflictos de interés: los autores declaran que no tienen conflictos de intereses relacionados con el tema de esta publicación.
Contribuciones de los autores: RG: idea conceptual y primera versión del manuscrito. EB, AMO: adaptación y revisión bibliográfica. BF, MDM, RG: corrección de versiones sucesivas. EB, AMO: coordinación de la discusión en todas las etapas. Todos los autores aprobaron el manuscrito final.
Los Editores en Jefe, Dr. Carlos Luna y Dr. Francisco Arancibia, realizaron el seguimiento del proceso de revisión y aprobaron este artículo.
Referencias
1. Radbruch L, De Lima L, Knaul F et al. Redefining Palliative Care-A New Consensus-Based Definition. J Pain Symptom Manage 2020; 60: 754-764. Doi: 10.1016/j.jpainsymman.2020.04.027.
2. Jacob G. Manual de cuidados paliativos para la atención primaria de la salud. 1a ed. Instituto Nacional del Cáncer. Ciudad Autónoma de Buenos Aires, 2014, pp. 276.
3. Haun MW, Estel S, Rücker G et al. Early palliative care for adults with advanced cancer. Cochrane Database Syst Rev 2017; 12; 6: CD011129. Doi: 10.1002/14651858.CD011129.pub2.
4. Lanken PN, Terry PB, Delisser HM et al. ATS End-of-Life Care Task Force. An official American Thoracic Society clinical policy statement: palliative care for patients with respiratory diseases and critical illnesses. Am J Respir Crit Care Med 2008; 5: 177: 912-27. Doi: 10.1164/rccm.200605-587ST.
5. Murray SA, Kendall M, Grant E, Boyd K, Barclay S, Sheikh A. Patterns of social, psychological, and spiritual decline toward the end of life in lung cancer and heart failure. Journal of Pain and Symptom Management 2007; 34: 393–402. Doi: 10.1016/j.jpainsymman.2006.12.009.
6. Tripodoro VA, Rynkiewicz MC, Llanos V, Padova S, De Lellis S, De Simone G. Atención paliativa en personas con enfermedades crónicas avanzadas. Medicina (Buenos Aires) 2016; 76: 139-147.
7. Organización Mundial de la Salud. 67° Asamblea Mundial de la Salud. Documento oficial en español. WHA67/2014/REC/1. [Internet]. [Consultado 6 Mar 2023]. Disponible en: https://apps.who.int/gb/ebwha/pdf_files/WHA67-REC1/A67_2014_REC1-sp.pdf
8. Temel JS, Greer JA, Muzikansky A et al. Early Palliative Care for Patients with Metastatic Non–Small-Cell Lung Cancer. N Engl J Med 2010; 363: 733-742. Doi: 10.1056/NEJMoa1000678.
9. Ferrel BR, Temel JS, Temin S et al. Integration of Palliative Care into Standard Oncology Care: American Society of Clinical Oncology Clinical Practice Guideline Update. Journal of Clinical Oncology 2017; 35: 96-112. Doi: 10.1200/JCO.2016.70.1474.
10. Gómez-Batiste X, Martínez-Muñoz M, Blay C et al. Identificación de personas con enfermedades crónicas avanzadas y necesidad de atención paliativa en servicios sanitarios y sociales: elaboración del instrumento NECPAL CCOMS-ICO. Med Clin (Barc) 2013; 140: 241-5. Doi: 10.1016/j.medcli.2012.06.027.
11. Escarrabill J, Soler-Cataluña JJ, Hernández C et al. Normativa SEPAR: recomendaciones sobre la atención al final de la vida en pacientes con EPOC. Arch Bronconeumol 2009; 45: 297–303. Doi: 10.1016/j.arbres.2008.11.005.
12. Boyd K, Murray S. Recognising and managing key transitions in end-of-life care. BMJ 2010; 341: 649-652. Doi: 10.1136/bmj.c4863.
13. Lange AV, Mehta AB, Bekelman DB. How Important is Spirometry for Identifying Patients with COPD Appropriate for Palliative Care? J Pain Symptom Manag 2023; 65: 181-e187. Doi: 10.1016/j.jpainsymman.2022.11.016.
14. Tripodoro VA, Llanos V, De Lellis S, Salazar Güemes C, De Simone GG, Gómez-Batiste X. Prognostic factors in cancer patients with palliative needs identified by the NECPAL CCOMS-ICO© tool. Medicina (B Aires) 2019;79: 95-103.
15. Tripodoro VA, Llanos V, Daud ML et al. Palliative and prognostic approach in cancer patients identified in the multicentre NECesidades PALiativas 2 study in Argentina. Ecancermedicalscience 2021;10: 16:1316. Doi: 10.3332/ecancer.2021.1316.
17. Bonilla Sierra P. Cuidados paliativos en Latinoamérica. RNCM 2020; 4 (2). Doi: 10.35454/rncm.v4n2.226.
18. Almagro P, Yun S, Sangil A et al. Palliative care and prognosis in COPD: a systematic review with a validation cohort. Int J Chron Obstruct Pulmon Dis 2017; 12: 1721-1729. Doi: 10.2147/COPD.S135657.
19. Brighton LJ, Bone AE, Maddocks M. Supportive and palliative care for people with chronic respiratory disease and frailty. Curr Opin Support Palliat Care 2020; 14: 206-212. Doi: 10.1097/SPC.0000000000000523.
20. Maddocks M, Lovell N, Booth S, Man WD, Higginson IJ. Palliative care and management of troublesome symptoms for people with chronic obstructive pulmonary disease. Lancet 2017; 2: 390(10098):988-1002. Doi: 10.1016/S0140-6736(17)32127-X.
21. Kreuter M, Bendstrup E, Russell AM et al. Palliative care in interstitial lung disease: living well. Lancet Resp Med 2017; 5: 968-980. Doi: 10.1016/S2213-2600(17)30383-1.
22. Tavares N, Jarrett N, Hunt K et al. Palliative and end-of-life care conversations in COPD: a systematic literature review. ERJ Open Res 2017; 3: 00068-2016. Doi: 10.1183/23120541.00068-2016.
23. Orgel E, McCarter R, Jacobs S. A failing medical educational model: a self-assessment by physicians at all levels of training of ability and comfort to deliver bad news. J Palliat Med 2010; 13: 677-83. Doi: 10.1089/jpm.2009.0338.
24. Baile WF, Buckman R, Lenzi R, Glober G, Beale EA, Kudelka AP. SPIKES-A six-step protocol for delivering bad news: application to the patient with cancer. Oncologist 2000; 5: 302-11. Doi: 10.1634/theoncologist.5-4-302.
25. Limón Ramírez E, Meléndez Gracia A, Mújica B. Afrontamiento de las pérdidas en la enfermedad crónica avanzada. En: Monografías SECPAL. Cronicidad avanzada. Inspira Network, Madrid, 2018, pp. 79–82.
26. Kübler-Ross E. On death and dying. Collier Books/Macmillan Publishing Co., 1970.
27. Spathis A, Booth S, Moffat C et al. The Breathing, Thinking, Functioning clinical model: a proposal to facilitate evidence-based breathlessness management in chronic respiratory disease. Prim Care Respir Med 2017; 27: 27. Doi: 10.1038/s41533-017-0024-z.
28. Lewhtwaite H, Williams G, Baldock KL et al. Systematic Review of Pain in Clinical Practice. Guidelines for Management of COPD: A Case for Including Chronic Pain? Healthcare 2019; 7: 15. Doi: 10.3390/healthcare7010015.
29. Verberkt CA, van den Beuken-van Everdingen MHJ, Schols JMGA et al. Effect of sustained-release morphine for refractory breathlesness in chronic obstructive pulmonary disease on health status. A randomized clinical trial. JAMA Intern Med 2020; 180: 1306-14. Doi: 10.1001/jamainternmed.2020.3134.
30. Bach JR. Palliative care becomes ‘uninformed euthanasia’ when patients are not offered noninvasive life preserving options. J Palliat Care 2007; 23:181–184.
31. Tripodoro VA, De Vito EL. Management of dyspnea in advanced motor neuron diseases. Curr Opin Support Palliat Care 2008; 2:173-9. Doi: 10.1097/SPC.0b013e32830c9049.
32. Barnes H, McDonald J, Smallwood N, Manser R. Opioids for the palliation of refractory breathlessness in adults with advanced disease and terminal illness. Cochrane Database Syst Rev 2016; 33:3(3):CD011008. Doi: 10.1002/14651858.CD011008.pub2.
33. Benítez-Rosario MA, Salinas-Martín A, Feria M. Oral transmucosal fentanyl citrate in the management of dyspnea crises in cancer patients. J Pain Symptom Manage 2005; 30: 395-7. Doi: 10.1016/j.jpainsymman.2005.10.002.
34. Higginson IJ, Wilcock A, Johnson MJ et al. BETTER-B Feasibility Trial Group. Randomised, double-blind, multicentre, mixed-methods, dose-escalation feasibility trial of mirtazapine for better treatment of severe breathlessness in advanced lung disease (BETTER-B feasibility). Thorax 2020; 75: 176-179. Doi: 10.1136/thoraxjnl-2019-213879.
35. Simon ST, Higginson IJ, Booth S, Harding R, Weingartner V, Bausewein C. Benzodiazepines for the relief of breathlessness in advanced malignant and non-malignant diseases in adults. Cochrane Database Syst Rev 2016; 10: Cd007354. Doi: 10.1002/14651858.CD007354.pub3.
36. Vertigan AE, Kapela SL, Ryan NM, Birring SS, McElduff P, Gibson PG. Pregabalin and speech pathology combination therapy for refractory chronic cough: a randomized controlled trial. Chest 2016; 149:639–48. Doi:10.1378/chest.15-1271.
37. Ryan NM, Birring SS, Gibson PG. Gabapentin for refractory chronic cough: a randomised, double-blind, placebo-controlled trial. Lancet 2012; 380: 1583–89. Doi: 10.1016/S0140-6736(12)60776-4.
38. Yohannes AM. Serotonergic antidepressants in COPD: beneficial or harmful? Eur Respir J 2018; 52: 1801095. Doi: 10.1183/13993003.01095-2018.
39. Ferreira IM, Brooks D, White J, Goldstein R. Nutritional supplementation for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2012;12:CD000998. Doi: 10.1002/14651858.CD000998.pub3.
40. Weisberg J, Wanger J, Olson J et al. Megestrol acetate stimulates weight gain and ventilation in underweight COPD patients. Chest 2002; 121: 1070–78. Doi: 10.1378/chest.121.4.1070.
41. Makhadami N, Farooqi M, Thom-Fernandes C, Raghavan NG. Pulmonary rehabilitation in interstitial lung diseases. Curr Opin Pulm Med 2020; 26: 470-6. Doi: 10.1378/chest.121.4.1070.
42. Bausewein C, Booth S, Gysels M, Higginson I. Non-pharmacological interventions for breathlessness in advanced stages of malignant and non-malignant diseases. Cochrane Database Syst Rev 2008; 16: CD005623. Doi: 10.1002/14651858.CD005623.pub2.
43. Abernethy A, McDonald C, Firth A et al. Effect of palliative oxygen versus room air in relief of breathlessness in patients with refractory dyspnoea: a doble-blind, randomised controlled trial. Lancet 2010; 376: 784-793. Doi: 10.1016/S0140-6736(10)61115-4.
44. Davies JD. Noninvasive respiratory support at the end of life. Respir Care 2019; 64: 701-11. Doi: 10.4187/respcare.06618.
45. Tripodoro VA, Rabec CA, De Vito EL. Withdrawing noninvasive ventilation at end-of-life care: is there a right time? Curr Opin Support Palliat Care 2019; 13: 344-350. Doi: 10.1097/SPC.0000000000000471.
46. Rajala K, Lehto JT, Saarinen M et al. End-of-life care of patients with idiopathic pulmonary fibrosis. BMC Palliat Care 2016; 15: 85. Doi: 10.1186/s12904-016-0158-8.
47. Mi E, Mi E, Ewing G et al. Associations between the psychological health of patients and carers in advanced COPD. Int J Chron Obstruct Pulmon Dis 2017;12:2813-2821. Doi: 10.2147/COPD.S139188.
48. Figueiredo D, Gabriel R, Jácome C, Cruz J, Marques A. Caring for relatives with chronic obstructive pulmonary disease: how does the disease severity impact on family carers? Aging Ment Health 2014;18:385-93. Doi: 10.1080/13607863.2013.837146.
49. Strang S, Fährn J, Strang P, Ronstad A, Danielsson L. Support to informal caregivers of patients with severe chronic obstructive pulmonary disease: a qualitative study of caregivers’ and professionals’ experiences in Swedish hospitals. BMJ Open 2019;9(8):e028720. Doi: 10.1136/bmjopen-2018-028720.
50. Kupeli N, Candy B, Tamura-Rose G et al. Tools Measuring Quality of Death, Dying, and Care, Completed after Death: Systematic Review of Psychometric Properties. Patient 2019; 12: 183-197. Doi: 10.1007/s40271-018-0328-2.
51. Mayland CR, Gerlach C, Sigurdardottir K et al. Assessing quality of care for the dying from the bereaved relatives’ perspective: Using pre-testing survey methods across seven countries to develop an international outcome measure. Palliat Med 2019; 33: 357-368. Doi: 10.1177/0269216318818299.
52. Hjorth NE, Hufthammer KO, Sigurdardottir K et al.; ERANet-LAC CODE project group; Core scientific group. Hospital care for the dying patient with cancer: does an advance care planning invitation influence bereaved relatives’ experiences? A two country survey. BMJ Support Palliat Care 2021; bmjspcare-2021-003116. Doi: 10.1136/bmjspcare-2021-003116.
53. Nakken N, Janssen DJA, van den Bogaart EHA. Informal caregivers of patients with COPD: Home Sweet Home? Eur Respir Rev 2015; 24: 498–504. Doi: 10.1183/16000617.00010114.
54. Surges SM, Garralda E, Jaspers B et al. Review of European Guidelines on Palliative Sedation: A Foundation for the Updating of the European Association for Palliative Care Framework. J Palliat Med 2022; 25:1721-1731. Doi: 10.1089/jpm.2021.0646.
55. Maglio I, Wierzba SM, Belli L, Somers ME. El derecho en los finales de la vida y el concepto de muerte digna. Rev Am Med Resp 2016; 1: 71-77.
56. Ley 26529/09, en su versión original y texto actualizado conf. L. 26.742/12. Consultado el 22 marzo 2023. Disponible en: https://www.argentina.gob.ar/normativa/nacional/ley-26529-160432.
57. Ley 27678 en su versión original. Boletín oficial de la República Argentina. 21/07/2022 N° 56041/22 v. 21/07/2022. [Internet]. [Consultado 22 Mar 2023]. Disponible en: https://www.argentina.gob.ar/normativa/nacional/ley-27678-368373.
58. Fresquet Febrer JL. Adolphe Gubler y el “Journal de Thérapeutique (1874-1883). Asclepio 1993; 45: 143-186. Doi: 10.3989/asclepio.1993.v45.2.490.