

REVISIÓN | Respirar, 2023; 15(1): 44-59 | ISSN 2953-3414 | https://doi.org/10.55720/respirar.15.1.6
Recibido:
28 diciembre 2022
Aprobado:
1 febrero 2023
Adrián Gallardo
Adrián Dévoli
Cinthia Gigliotti
Eder Zamarrón-López
Orlando R. Pérez-Nieto
Juan Martín Núñez Silveira
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
Cánula nasal de alto flujo en pacientes críticos: una revisión narrativa
High Flow Nasal Cannula in Critically Ill Patients:
a Narrative Review
Adrián Gallardo1 , Adrián Dévoli2
, Adrián Dévoli2 , Cinthia Gigliotti2
, Cinthia Gigliotti2 , Eder Zamarrón-López3
, Eder Zamarrón-López3 , Orlando R. Pérez-Nieto4
, Orlando R. Pérez-Nieto4 , Juan Martín Núñez Silveira5
, Juan Martín Núñez Silveira5
1. Sanatorio Clínica Modelo de Morón, Servicio de Kinesiología, Morón, Buenos Aires, Argentina.
2. Sanatorio Clínica Modelo de Morón, Departamento de Clínica Médica Morón, Buenos Aires, Argentina.
3. Hospital General Regional IMSS No. 6, Unidad de Cuidados Intensivos, Tamaulipas, México.
4. Hospital General San Juan del Río, Unidad de Cuidados Intensivos, Querétaro, México.
5. Hospital Italiano de Buenos Aires, Unidad de Terapia Intensiva, Ciudad de Buenos Aires, Argentina.
Autor CORRESPONSAL:
Adrián Gallardo, adriankgallardo@gmail.com
Resumen
La cánula nasal de alto flujo se ha convertido en una de las principales estrategias de soporte ventilatorio no invasivo en la insuficiencia respiratoria aguda hipoxémica, principalmente después de la pandemia de COVID-19. Sin embargo, su uso se extiende más allá de este escenario y abarca diferentes condiciones clínicas como el período postextubación, período postquirúrgico, insuficiencia respiratoria hipercápnica y soporte vital en pacientes inmunodeprimidos, trasplantados u oncológicos. Los manuscritos que avalan su aplicación han sido ampliamente difundidos y el grado de evidencia es lo suficientemente alto como para recomendar su uso. Por tanto, es necesario destacar sus efectos fisiológicos como el confort, una fracción inspirada de oxígeno precisa, el lavado de CO2 o la optimización del volumen pulmonar de fin de espiración para comprender su mecanismo de acción y mejorar los resultados de los pacientes.
El objetivo de esta revisión narrativa es ofrecer un resumen breve y conciso de los efectos y beneficios de aplicar esta terapia en diferentes escenarios clínicos sin la estructura rígida de una revisión sistemática. Con base en estas líneas, el lector curioso puede ampliar la evidencia científica que avala el empleo de la cánula nasal de alto flujo en cada escenario particular.
Palabras clave: cánula nasal de alto flujo, efectos, beneficios, riesgos potenciales.
Abstract
High-flow nasal cannula has become one of the main strategies for non-invasive ventilatory support in hypoxemic acute respiratory failure, mainly after the COVID-19 pandemic. However, its use extends beyond this scenario and covers different clinical conditions such as the post-extubation period, post-surgical period, hypercapnic respiratory failure and life support in immunosuppressed, trasplant or cancer patients. Manuscripts that support its application have been widely disseminated and the degree of evidence is high enough to recommend its use. Therefore, it is necessary to highlight its physiological effects such as comfort, precise fraction of inspiratory oxygen, CO2 lavage or optimize end-expiratory lung volume to understand its mechanism of action and improve patients’ outcomes.
The objective of this narrative review is to offer a brief and concise summary of the benefits of applying this therapy in different clinical scenarios without the rigid structure of a systematic review. Based on these lines, the curious reader can expand the scientific evidence that supports the use of the high-flow nasal cannula in each particular scenario.
Keywords: high flow nasal cannula, effects, benefits, pontential risk.
Introducción
La oxigenoterapia administrada a través de la cánula nasal de alto flujo (CNAF) se ha vuelto popular para el tratamiento de la insuficiencia respiratoria aguda (IRA), principalmente durante la pandemia de COVID-19. Existe suficiente evidencia sobre los efectos y beneficios fisiológicos de la CNAF en diversos escenarios y patologías, por lo que es importante familiarizarse con su uso, indicaciones y limitaciones. El objetivo de esta revisión es actualizar y resumir muchas de las pruebas disponibles en un texto simple, directo y conciso. Aunque no hemos realizado una búsqueda sistemática, la información incluida cubre los aspectos más relevantes de esta terapia.
Efectos fisiológicos
Se ha dedicado considerable atención a comprender los beneficios y los mecanismos de acción de CNAF (figura 1).
Figura 1.
Equipamiento y componentes de la cánula nasal de alto flujo. Masclans et al. Medicina Intensiva (2015)
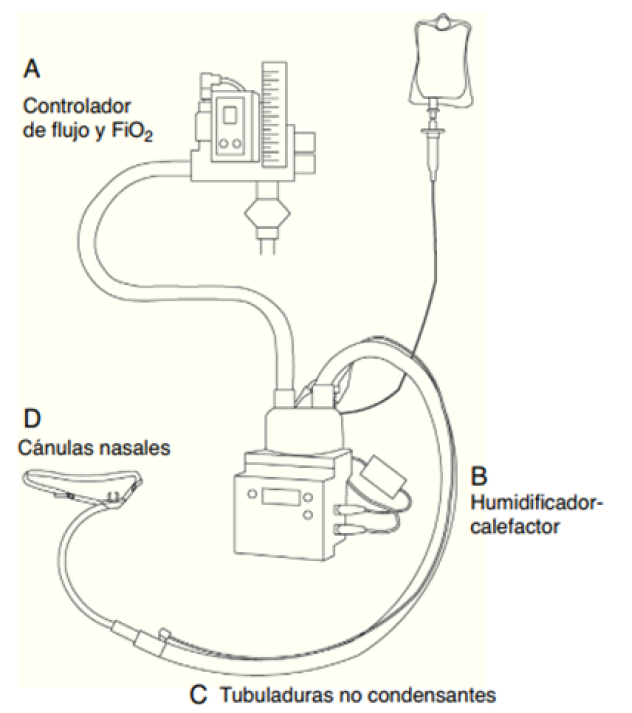
Figura 2.
Efectos y beneficios de la cánula nasal de alto flujo. CO2: dióxido de carbono. EELV: volumen pulmonar de fin de espiración. WOB: trabajo respiratorio. FR: frecuencia respiratoria. PEEP: presión positiva al final de la espiración. IMV: ventilación mecánica invasiva. SO: oxigenoterapia estándar. IOT: intubación orotraqueal. UCI: unidad de cuidados críticos. P-SILI: injuria pulmonar autoinducida.

A diferencia de los dispositivos de bajo flujo, que entregan una fracción inspirada de oxígeno (FiO2) variable y pueden tener fugas significativas, los dispositivos de alto flujo pueden entregar una FiO2 más precisa. Debido a que el aumento de la FiO2 genera un aumento de la presión inspirada de oxígeno y de la presión alveolar de oxígeno,1,2 su principal efecto es la mejoría de la oxigenación, evidenciada por el aumento de la saturación periférica de oxígeno (SpO2) y la presión parcial de oxígeno en sangre arterial (PaO2).
Otro efecto es la generación de presión positiva al final de la espiración (PEEP): se han informado presiones nasofaríngeas de 1-4 cmH2O; si el paciente respira con la boca abierta, la presión será menor.3,4 Aunque es de mencionar que un estudio de banco reciente reporta un máximo de 1,5 cmH2O con 60L/min.5 El efecto PEEP podría aumentar el volumen pulmonar al final de la espiración (EELV). Este efecto, además de mejorar la oxigenación, podría reducir el colapso de las vías respiratorias pequeñas, prevenir las atelectasias y el atrapamiento aéreo.2,6 Además, se ha demostrado que la CNAF mejora la eliminación de CO2 y reduce el drive ventilatorio.7 Además, el alto flujo reduce la resistencia de las vías respiratorias y proporciona humedad y calor adecuados, lo que reduce los costos de energía.8 Por este motivo, se ha considerado su uso en la enfermedad pulmonar obstructiva crónica (EPOC).9,10
Algunos estudios han evaluado el trabajo respiratorio (WOB). Vargas et al. compararon el WOB durante la oxigenoterapia estándar (SO) en 12 pacientes con IRA y encontraron una reducción del 25% con el empleo de CNAF a 60 L/min.11 Delorme et al. midieron el WOB a 20, 40, 60 L/min en pacientes que se recuperaban de IRA y encontraron una disminución del WOB dependiente del flujo del 50% usando 60 L/min.12 Otro estudio midió el WOB con CNAF a 40 L/min e informó una disminución del 25% en comparación con la SO;2 mientras que un estudio posterior mostró que la magnitud del efecto dependía del flujo, con una reducción de hasta el 40% en el WOB a 60 L/min.6 Además, se demostró que la compliancia dinámica aumenta.2,6,12 Todo lo anterior podría explicar la reducción de la frecuencia respiratoria (FR) y la ventilación minuto (VM) en pacientes con IRA.2 La CNAF también contribuye a mejorar la homogeneidad de la ventilación alveolar y reduce el estrés y la tensión durante la ventilación espontánea, lo que sugiere que podría prevenir la lesión pulmonar autoinfligida (P-SILI).13
Otros posibles beneficios atribuidos a la CNAF son la mejoría de la eliminación de secreciones y la reducción de los episodios obstructivos de las vías respiratorias superiores.1,14 Tiruvoipati et al.15 realizaron un ensayo cruzado para comparar el impacto de la CNAF posterior a la extubación frente a la mascarilla facial convencional; no encontraron diferencias en el intercambio de gases, pero sí una mejor tolerancia a la CNAF. Rittayamai et al.16 compararon el efecto de la CNAF frente a la máscara sin reinhalación sobre la disnea, la comodidad y los signos vitales. Observaron menos disnea, menor FR y frecuencia cardíaca (FC) con la CNAF. Finalmente, Maggiore et al. compararon la CNAF versus máscara Venturi durante 48 horas después de la extubación y encontraron que la CNAF produjo una mejor oxigenación y una menor PaCO2 y FR.1 Los efectos y beneficios de la CNAF se resumen en la figura 2.
CNAF en insuficiencia respiratoria aguda
Existen múltiples entidades clínicas que predisponen al desarrollo de hipoxemia. Entre los dispositivos utilizados para su tratamiento, CNAF promueve una mejoría en los parámetros ventilatorios dependientes del flujo17 y puede considerarse como un tratamiento de primera línea para estos pacientes. Debido a que genera un efecto tipo CPAP con aumento de EELV, disminución de FR, WOB y precarga ventricular derecha y logra así una mejoría del patrón hemodinámico,18 se ha recomendado su uso sobre SO.19 La CNAF se ha utilizado tradicionalmente en situaciones de dificultad respiratoria debido a su capacidad para mejorar la oxigenación y ser más cómoda, aunque existen controversias respecto a su superioridad sobre SO y el riesgo de retrasar la intubación orotraqueal (IOT) en diferentes escenarios.20 Un metanálisis no mostró diferencias significativas en la duración de la estancia en la UCI, la necesidad de ventilación mecánica invasiva (IMV), la mortalidad a los 28 días y la SpO2 al final de la oxigenoterapia.21 La IOT tardía se ha asociado con peores resultados clínicos secundarios a la fatiga de los músculos respiratorios, la disfunción cardíaca y la falla multiorgánica.17 Sin embargo, Xiaofeng et al.22 demostraron una menor tasa de IOT en pacientes con CNAF vs SO; no es así con la ventilación no invasiva (VNI).
CNAF para evitar la intubación
La mejoría que muestran los pacientes con CNAF, en comparación con los que usan SO o VNI, ha sido descrita previamente.23,24 Rochwerg et al.25 mostraron resultados similares. Además, un estudio controlado y aleatorizado (ECA) encontró que no había diferencias, en términos de tasa de IOT, en pacientes con insuficiencia respiratoria que usaban CNAF o VNI.26 Adicionalmente, una revisión27 encontró resultados favorables para CNAF, observándose diferencias significativas en la tasa de IOT, en comparación con SO, pero no con VNI. A pesar de lo anterior, no todos los estudios muestran hallazgos similares. Algunos autores28 cuestionan la disparidad en los criterios de inclusión de los diferentes estudios y el tamaño muestral presentado en el análisis que no pudo alcanzar la potencia suficiente para descartar la hipótesis nula y arrojan resultados controvertidos.
Período posterior a la extubación
La CNAF ha demostrado tener éxito en situaciones clínicas específicas. En un ensayo que incluyó 310 pacientes no intubados con IRA hipoxémica (IRAh), la CNAF redujo la mortalidad y la necesidad de intubación, en comparación con la SO o la VNI.24 En pacientes inmunosuprimidos con IRA, varios estudios han demostrado que la CNAF puede ser superior a la SO y la VNI.29 En pacientes quirúrgicos, la CNAF se ha utilizado para prevenir la IRA posoperatoria y la reintubación.30,31
El empleo de CNAF para prevenir el fracaso de la extubación ha sido uno de los escenarios más estudiados.32 En un ECA, Maggiore et al.1 compararon CNAF con máscara Venturi en pacientes con PaO2/FiO2 <300. Encontraron una tasa de reintubación más baja con CNAF, mejor oxigenación y menos molestias. Más tarde, Hernández et al. publicaron un ECA que comparaba CNAF con SO después de la extubación y encontraron que CNAF disminuía la reintubación, pero no se observó ningún impacto en la duración de la estancia en la UCI ni en la mortalidad.14 Sin embargo, a pesar de los resultados positivos de este ensayo, todavía no se recomienda la aplicación rutinaria de CNAF.19,33
Posteriormente, se presentaron dos ECA en pacientes con alto riesgo de reintubación. En el primero, compararon la CNAF con la VNI tras la extubación; no se encontraron diferencias en las tasas de reintubación.14 La CNAF demostró no ser inferior a VNI en la prevención de fallas en la extubación. El segundo comparó CNAF con SO y, debido al lento reclutamiento, se suspendió prematuramente. No hubo diferencias significativas en la reintubación ni en ningún resultado relevante.34 Los criterios utilizados para determinar el alto riesgo de reintubación en estos estudios se basaron en factores de riesgo asociados con resultados que no han sido validados prospectivamente.33,35 Aunque estos estudios pueden respaldar el papel de la CNAF después de la extubación, existen dudas sobre qué pacientes pueden realmente beneficiarse de la terapia.
CNAF y COVID-19
Los pacientes con COVID-19 presentan síntomas variados y una pequeña población puede presentar IRA que requiera ventilación invasiva o no invasiva. La oxigenoterapia es vital y determina en muchos casos el pronóstico clínico. Diferentes trabajos abordaron este punto utilizando CNAF, SO, VNI o CPAP. La CPAP o la VNI a veces son incómodas, pueden provocar úlceras por decúbito, requieren control constante y pueden aumentar significativamente el espacio muerto. En este sentido, se propuso como opción CNAF.
Al comienzo de la pandemia, Hu et al.36 observaron una mejoría en la oxigenación en el 61,9% de los pacientes y que los índices de oxigenación estaban estrechamente relacionados con el pronóstico: un índice ROX ([SpO2/FiO2]/FR) mayor a 5,55 se asoció significativamente con el éxito de la terapia.
Poco tiempo después, un estudio retrospectivo37 incluyó a 46 pacientes que se dividieron en tres grupos: decisión de no intubar, sin requerimientos de IOT y eventualmente IOT. Encontraron que los pacientes que finalmente requirieron IOT tenían una FR más alta y una peor relación PaO2/FiO2 al ingreso en la UCI. Este subgrupo mostró una tasa de mortalidad del 35%, mientras que los pacientes con CNAF sobrevivieron.
Zhao et al.38 informan que la VNI no es superior a la CNAF en términos de IOT y mortalidad, aunque observaron un aumento significativo en el índice SpO2/FiO2. Otro estudio39 mostró la viabilidad de utilizar una terapia combinada de CNAF y CPAP, con resultados favorables (tasa de IOT 26,54%, mortalidad global 14,15%). Aunque el estudio no fue diseñado para evaluar la precisión del índice ROX, informan que un valor de 6,28 mostró una sensibilidad del 97,6% y una especificidad del 51,8%. Este valor difiere del reportado por Ferrer et al.40 quienes encontraron un valor > 5.35 como predictor de éxito de la CNAF.
El estudio de Garner et al.41 evaluó los predictores de fracaso de la CNAF en pacientes con COVID-19 y encontró fracaso en el 76,7% de los que presentaban una puntuación SOFA superior al ingreso y al menos una comorbilidad o antecedentes de inmunosupresión. Otro estudio retrospectivo,41 con pacientes que usaron CNAF o vni, mostró que casi la mitad de los pacientes que usaron CNAF tuvieron que usar VNI posteriormente como terapia de rescate. A pesar de lo anterior, los autores concluyen que no hubo diferencias significativas entre los grupos en términos de duración de la terapia, tasa de IOT o mortalidad.
Hasta donde sabemos, hay pocos ECA que evalúen la eficacia de la terapia CNAF, en comparación con SO o VNI, en esta población. Estos estudios arrojan resultados contradictorios. Teng et al43 informan que la FC y la FR fueron mejores en el grupo CNAF después de 6 h, mientras que el índice PaO2/FiO2 fue mayor a las 6 h, 24 h y 72 h. Por otro lado, el estudio de Ospina-Tascón et al.44 incluyó 199 y evaluó la tasa de IOT y la recuperación clínica al día 28. Reportaron una tasa de IOT del 34,3% para CNAF y del 51,0% para SO y una mediana de recuperación clínica de 11 días para el grupo CNAF y de 14 días para el grupo SO. El estudio RECOVERY RS,45 por el contrario, evaluó la tasa de IOT a los 30 días en tres brazos de tratamiento. Los autores informan una tasa de IOT del 41,6% para el grupo SO, 41,1% para el grupo CNAF y 33,4% para el grupo CPAP. La tasa de mortalidad a los 30 días fue: SO 18,8% vs. CNAF 20% y SO 19,2% vs CPAP 16,7%. Por lo tanto, la terapia CNAF no se asoció con una tasa más baja de IOT o mortalidad en comparación con SO. Este hallazgo coincide con lo informado en un estudio reciente de casos y controles.46 Además, Crimi et al.47 no encontraron beneficio en el uso de CNAF en pacientes con hipoxemia leve debido a COVID-19.
CNAF y prono vigil
El posicionamiento en decúbito prono despierto en pacientes con IRA y CNAF ganó popularidad durante la pandemia de COVID-19; sin embargo, sigue siendo un tema de debate con respecto a los resultados clínicos. Un metaensayo multicéntrico demostró una menor necesidad de intubación y mejores resultados en pacientes que permanecieron en decúbito prono durante más de 8 horas.48 Los metanálisis y otros estudios multicéntricos han demostrado una asociación con una tasa más baja de IOT y una disminución de la mortalidad,49,50 incluso en SDRA grave.51 En cuanto a cuándo iniciar esta posición, se ha demostrado una mayor tasa de éxito si se utiliza antes de las 24 h del uso de CNAF.52
CNAF en insuficiencia respiratoria hipercápnica
La terapia con CNAF se usa ampliamente en pacientes con IRAh y sus beneficios han sido ampliamente informados; sin embargo, la evidencia en pacientes con falla respiratoria hipercápnica es limitada. El uso de CNAF en pacientes con hipercapnia aumentó después de que se demostró una reducción en la reinhalación de CO2.13,53 Fricke et al. demostraron que las CNAF reducen los niveles de CO2 mediante el lavado del espacio muerto en las vías respiratorias superiores mediante la medición invasiva del CO2 inspirado, ETCO2 por cateterismo trans-traqueal y del CO2 transcutáneo en un paciente con traqueostomía.54 La aplicación de un flujo de 30L/min generó un efecto de CPAP de 1 cm H2O, redujo el CO2 inspirado de 6 a 3 mmHg y el CO2 transcutáneo de 68 a 63 mm Hg, lo que ocurrió desde el inicio de la terapia, y logró una reducción en el volumen minuto de 7.2 a 6.5 L/min. La mejoría en la ventilación podría explicarse mediante la disminución del espacio muerto anatómico en la vía respiratoria de conducción ocasionado por el flujo elevado de O2. Incluso una pequeña disminución del espacio muerto puede mejorar significativamente la ventilación y reducir la hipercapnia por incremento del volumen alveolar y disminución de la PaCO2, explicado por la siguiente ecuación:
PaCO2 = k (VCO2 / VA) = k (VCO2 / VE – VD)
donde la presión arterial de CO2 es igual a la producción de CO2 dividido entre la ventilación alveolar (VA), misma que puede calcularse con la resta del espacio muerto (VD) al volumen minuto (VE). Estudios subsecuentes sobre el uso de CNAF en pacientes con EPOC, neumonía y otras causas de falla respiratoria hipercápnica han dado soporte a estos hallazgos55 y un estudio aleatorizado controlado de Alnajada et al. que compara el uso de CNAF contra dispositivos de bajo flujo como terapéutica inicial en pacientes con falla respiratoria hipercápnica podrá contribuir a determinar cuál podría ser el mejor abordaje para estos pacientes.56
Debido a que la VNI ha sido la terapéutica estándar en pacientes con falla respiratoria e hipercapnia, se han realizado estudios comparativos para probar la seguridad y eficacia del uso de CNAF en este tipo de insuficiencia respiratoria. En un estudio que evaluó el uso de HFNC frente a VNI para el tratamiento de la hipercapnia moderada, los autores no encontraron diferencias significativas en la tasa de IOT a las 48 h; pero al evaluarlo a los 28 días, los pacientes con CNAF presentaron valores más altos.57 Asimismo, estos pacientes mostraron mayor mortalidad a los 28 días y mayor estancia en UCI. En un grupo similar, Nam et al.58 observaron que la CNAF producía una reducción significativa de la PaCO2 pero sin cambios significativos en la FR, el bicarbonato o el índice PaO2/FiO2, mientras que la IMV se evitaba en el 93,3% de los casos. Por otro lado, al comparar CNAF y VNI, Lee et al.59 no reportaron diferencias en la tasa de IOT o mortalidad a los 30 días. Tampoco encontraron diferencias significativas en los valores de pH, PaO2 y PaCO2. McKinstry et al.,60 sin embargo, encontraron que la aplicación de CNAF a pacientes con EPOC reducía los valores de CO2 transcutáneos y la FR, con un aumento en el flujo. La reducción de CO2 después de implementar CNAF durante 1 h también se observó en un estudio prospectivo, observacional y analítico.61 Sun et al.62 estudiaron pacientes con insuficiencia respiratoria hipercápnica moderada. Compararon los resultados de los pacientes tratados con CNAF o VNI. No encontraron diferencias significativas en la tasa de fracaso o mortalidad. También informan que el tiempo de aplicación fue mayor en pacientes con CNAF. Kim et al.63 estudiaron la aplicación de CNAF en pacientes con IRA e hipercapnia. Utilizaron caudales no superiores a 50 L/min y FiO2 <0,5 y, al compararlo con SO, observaron una reducción en la concentración de CO2. Finalmente, Bae et al.64 evaluaron la eficacia de la CNAF en comparación con pacientes que solo tenían IRA y observaron que la mortalidad hospitalaria y en la UCI sin ajustar era menor en los pacientes con CNAF. Al ajustar estos datos no se encontraron diferencias significativas. Finalmente, una revisión sistemática y metanálisis que comparó la utilización de CNAF contra VNI en falla respiratoria hipercápnica, incluyendo paciente con EPOC exacerbado, fibrosis quística y otras causas de hipoventilación, demostró que no existen diferencias significativas entre ambas terapias respiratorias en cuanto a mortalidad (RR 0.86, CI95% 0.48–1.56), necesidad de intubación (RR 0.80, CI95% 0.46–1.39), días de estancia en UCI, días de hospitalización, confort o resolución de la disnea, por lo que las CNAF son una opción para el tratamiento de esta entidad.65 Respecto al manejo post-extubación de pacientes con EPOC, un estudio aleatorizado controlado que comparó el uso de CNAF contra VNI demostró que no hubo diferencias en cuanto a falla al tratamiento (RR 5.8%, CI95% 23.8-12.4%, p 0.535), pero las CNAF se asociaron a mayor confort y menos lesiones faciales (7 (6-8) vs 5 (4-7), p < 0.001) y (0 vs 9.6%, p 0.027), respectivamente.66
Pacientes inmunosuprimidos, trasplantados y cáncer
El empleo de CNAF en pacientes inmunodeprimidos es controvertido. Existe evidencia sobre la disminución de la IOT en la IRA y el SDRA.67 La tolerancia adecuada, el flujo termohumidificado, la FiO2 estable, así como sus características no invasivas parecen ser una opción razonable de tratamiento. Las revisiones sistemáticas han demostrado estas ventajas.68,69 Estos estudios encontraron una reducción en la tasa de IOT, pero no en el riesgo de mortalidad. Ricard et al.17 proponen: “Una posible explicación es que la enfermedad de base de los pacientes y/o el factor precipitante que conduce a la IRA en pacientes inmunocomprometidos requiere más tiempo de recuperación. En consecuencia, estos pacientes pueden tener una dependencia de oxígeno más duradera y pueden requerir procedimientos más invasivos. (…) Por todas estas razones, la naturaleza del soporte ventilatorio puede no tener tal impacto en este contexto particular”. Metaanálisis evidencian resultados contrariados en el estudio de una población heterogénea.70-72 El avance del tratamiento farmacológico y la directiva anticipada de no IOT son confundidores. La edad avanzada y las infecciones oportunistas, principal causa de IRA y mortalidad, se asocian con una mayor tasa de IOT73 y la CNAF no tendría superioridad en enfermedades tumorales sólidas y oncohematológicas.70 Su empleo en combinación con VNI no disminuiría la mortalidad.74
Para los pacientes con trasplante de pulmón, se informó que la reducción del riesgo absoluto de IMV con CNAF fue del 29,8%. El análisis multivariado mostró que el tratamiento con CNAF fue la única variable, al ingreso en la UCI, asociada con una disminución del riesgo de IMV. Además, aquellos pacientes que no requirieron IMV mostraron una mayor tasa de supervivencia y no reportaron eventos adversos asociados con su uso.23
Con respecto a los pacientes con cáncer, un estudio informó que el uso de CNAF-VNI resultó en una menor mortalidad a los 28 días; mayor tiempo desde el ingreso a IOT y mayor, pero no significativo, número de días sin ventilador, en comparación con los pacientes que usaron SO o VNI.30 Además, después de ajustar por Propensity Score, CNAF-VNI se asoció de forma independiente con las tasas de supervivencia, mientras que la tasa de IOT fue similar para ambos grupos.
Período post-quirúrgico
En una revisión sistemática y metaanálisis, Lu et al.75 observaron que el empleo de CNAF después de la cirugía se asoció, significativamente, con una reducción de la estancia hospitalaria. Estos hallazgos no se acompañaron de una reducción de la mortalidad, la reintubación o las complicaciones pulmonares. Otra revisión sistemática y metanálisis76 mostró que la CNAF se asoció con una tasa más baja de reintubación y una reducción de requerimiento de IMV; mientras que otro estudio77 mostró que CNAF reduce significativamente la hipercapnia y la tasa de IOT.
En cuanto a la comodidad, se ha demostrado que en los pacientes oncológicos intervenidos de esofagectomía, el dolor de garganta y/o nariz en el grupo tratado con CNAF fue menor, mientras que la producción de esputo fue mayor y la estancia hospitalaria total fue menor. Además, la CNAF disminuyó la presión arterial sistólica, la presión arterial diastólica y la FC, aumentó la PaO2 y la SpO2 en el período posoperatorio.78
CNAF como adyuvante de la intubación orotraqueal
Se han utilizado muchas técnicas de preoxigenación para alcanzar una concentración de oxígeno correcta durante el período previo a la intubación orotraqueal. Mediante el empleo de CNAF se podrían abordar situaciones como la preoxigenación (principalmente en pacientes con riesgo de desaturación), procedimientos endoscópicos, vías aéreas de difícil acceso o cirugías laríngeas. CNAF proporciona una FiO2 al 100% y un flujo humidificado y calentado que es más confortable y tolerable, a pesar de utilizar flujos de 60 L/min, o mayores. Sin embargo, se han informado resultados contradictorios con respecto a la oxigenación apneica79-81 y, por ello, se ha propuesto el uso de ventilación no invasiva combinada con CNAF.82 Un estudio reciente que evaluó la oxigenación, usando CNAF durante una inducción de secuencia rápida, mostró menor desaturación en comparación con una preoxigenación con máscara facial convencional.83 Estos resultados fueron diferentes a los informados en pacientes sometidos a bloqueos neuromusculares (en cuanto al mantenimiento de la PaO2 y la PaCO2).84 Finalmente, la CNAF parece proporcionar una preoxigenación rápida y segura en personas obesas antes de la anestesia general,85 pero en mujeres embarazadas parece no ser recomendable como herramienta de preoxigenación.86
Monitorización
Existen múltiples estrategias de monitorización, la mayoría basadas en índices o parámetros clínicos fáciles de evaluar.87 (Tabla 1).
Tabla 1.
Resumen de algunos de los estudios más representativos sobre los efectos de la CNAF.
|
Estudio / Autor |
Objetivo |
Pacientes (n) |
Resultados |
|
Terapia de oxígeno nasal de alto flujo versus máscara Venturi después de la extubación. Efectos sobre la oxigenación, la comodidad y el resultado clínico Maggiore, SM, et al. |
Comparar los efectos de la máscara Venturi y la CNAF sobre la relación PaO2/FiO2 después de la extubación. Criterios de valoración secundarios: evaluar los efectos sobre el malestar del paciente, eventos adversos y los resultados clínicos. |
105 pacientes con PaO2/FiO2 ≤ 300 inmediatamente antes de la extubación. Venturi (n 52) o CNAF (n 53) |
En comparación con la máscara Venturi, CNAF da mejor oxigenación para la misma FiO2 después de la extubación. El uso de CNAF se asocia con una mayor comodidad, menos desaturaciones y desplazamientos de interfaz, y una menor tasa de reintubación. |
|
Soporte óptimo mediante cánula nasal de alto flujo en insuficiencia respiratoria hipoxémica aguda: efectos del aumento de las tasas de flujo Mauri T et al. |
Evaluar los efectos de CNAF administrada a una velocidad de flujo creciente sobre el esfuerzo inspiratorio, el WOB, la ventilación por minuto, los volúmenes pulmonares, la compliancia dinámica y la oxigenación en pacientes con IRAh |
Estudio prospectivo aleatorizado cruzado con 17 pacientes |
Una tasa de flujo creciente disminuyó progresivamente el esfuerzo inspiratorio y mejoró la aireación pulmonar, la compliancia dinámica y la oxigenación. |
|
Efectos de la cánula nasal de alto flujo sobre el trabajo respiratorio en pacientes que se recuperan de insuficiencia respiratoria aguda Delorme M et al. |
Evaluar los efectos de CNAF sobre los índices de esfuerzo respiratorio (variaciones de la presión esofágica, producto de presión-tiempo esofágico/min y WOB/min) |
Estudio aleatorizado controlado cruzado en 12 pacientes |
CNAF a 60 L/min, reduce significativamente los índices de esfuerzo respiratorio en pacientes que se recuperan de IRA. Este efecto se asocia con una mejoría en la mecánica respiratoria. |
|
El papel de la cánula nasal de alto flujo como estrategia de soporte respiratorio en adultos: una guía de práctica clínica Rochwerg B et al. |
Recomendaciones basadas en evidencia con respecto al empleo de CNAF en varios entornos clínicos. |
Esta guía de práctica clínica sintetiza la mejor evidencia actual en cuatro recomendaciones para el uso de CNAF en pacientes con IRAh después de la extubación, en el período de periintubación y en período postquirúrgico |
|
|
La terapia de apoyo con cánulas nasales de alto flujo humidificadas mejora los resultados en los receptores de trasplante de pulmón readmitidos en la unidad de cuidados intensivos debido a insuficiencia respiratoria aguda Roca O et al. |
Determinar la eficacia de la CNAF en pacientes con trasplante de pulmón readmitidos en la UCI debido a IRA. |
37 pacientes trasplantados |
CNAF es factible y segura y puede disminuir la necesidad de ventilación mecánica en estos pacientes |
|
Oxígeno de alto flujo a través de cánula nasal en insuficiencia respiratoria hipoxémica aguda Frat JP et al. |
Se debate si la VNI debe administrarse en pacientes con IRA hipoxémica. La terapia con CNAF puede ofrecer una alternativa en pacientes con hipoxemia. |
310 pacientes |
En pacientes con IRAh no hipercápnica, el tratamiento con CNAF, oxígeno estándar o VNI no resultó en tasas de intubación significativamente diferentes. Hubo una diferencia significativa a favor de CNAF en la mortalidad a los 90 días. |
|
Un ensayo controlado aleatorio de oxígeno nasal de alto flujo (Optiflow) como parte de un programa de recuperación mejorado después de una cirugía de resección pulmonar Ansari BM et al. |
Evaluar el uso rutinario de CNAF en pacientes sometidos a cirugía torácica. |
59 pacientes fueron asignados aleatoriamente a CNAF (n 28) u oxígeno estándar (n 31) |
La CNAF profiláctica, cuando se incorporó a un programa de recuperación mejorada, no mejoró los resultados de la prueba de caminata de 6 minutos, pero se asoció con una menor duración de la estadía en el hospital y una mayor satisfacción después de la resección pulmonar, en comparación con el oxígeno estándar. |
|
Oxígeno de cánula nasal de alto flujo en adultos: una evaluación basada en la evidencia Draco MG |
Evaluar CNAF en términos de suministro de O2 y eliminación de CO2 dependiente del flujo, WOB y demanda inspiratoria durante la IRA |
Esta revisión examina la evidencia de la oxigenación CNAF, incluido un enfoque en los efectos en la fisiología respiratoria y las claves para adaptar el flujo a escenarios clínicos específicos. |
|
|
Índice ROX como predictor del éxito de la terapia con cánula nasal de alto flujo en la insuficiencia respiratoria aguda por SARS-CoV-2 Ferrer S et al. |
Determinar si el índice ROX podría predecir el éxito de la terapia CNAF en pacientes con IRA debido a neumonía por SARS-CoV-2. |
85 pacientes |
El índice ROX a las 24 h con un punto de corte de 5,35 predice el éxito de la CNAF en pacientes con IRA inducida por SARS-Cov-2. |
|
Efecto de la oxigenoterapia de alto flujo frente a la oxigenoterapia convencional sobre la ventilación mecánica invasiva y la recuperación clínica en pacientes con COVID-19 grave: un ensayo clínico aleatorizado Ospina-Tascón GA et al. |
Determinar el efecto de la oxigenoterapia de alto flujo a través de una cánula nasal en comparación con la oxigenoterapia convencional sobre la necesidad de intubación endotraqueal y la recuperación clínica en pacientes con COVID-19 grave. |
Los pacientes fueron asignados al azar para recibir oxígeno de alto flujo a través de una cánula nasal (n = 109) u oxigenoterapia convencional (n = 111). |
El uso de CNAF redujo significativamente la necesidad de soporte de ventilación mecánica y el tiempo de recuperación clínica en comparación con la oxigenoterapia convencional de bajo flujo. |
|
Efecto de las estrategias respiratorias no invasivas sobre la intubación o la mortalidad entre pacientes con insuficiencia respiratoria hipoxémica aguda y COVID-19 Perkins GD et al. |
¿Cuál es el efecto de las estrategias respiratorias no invasivas que usan CPAP o CNAF, en comparación con una estrategia inicial de oxigenoterapia convencional, sobre el riesgo de intubación traqueal o mortalidad entre adultos hospitalizados con IRAh debido a COVID-19? |
1273 pacientes |
Una estrategia inicial de CPAP redujo significativamente el riesgo de IOT o mortalidad en comparación con la oxigenoterapia convencional, pero no hubo diferencias significativas entre una estrategia inicial de CNAF en comparación con la oxigenoterapia convencional. |
|
Posicionamiento en decúbito prono despierto para la insuficiencia respiratoria hipoxémica aguda por COVID-19: un metaensayo aleatorizado, controlado, multinacional y abierto Ehrmann S et al. |
Evaluar la eficacia del posicionamiento en decúbito prono despierto para prevenir la intubación o la muerte en pacientes con COVID-19 grave |
Se incluyeron 1126 pacientes y se asignaron aleatoriamente a posición prona despierto (n=567) o atención estándar (n=559) |
El prono vigil en pacientes con IRAh debido a COVID-19 reduce la incidencia de falla del tratamiento y la necesidad de intubación sin ninguna señal de daño. |
|
Impacto del tiempo de exposición en posición boca abajo despierto en los resultados clínicos de pacientes con insuficiencia respiratoria aguda relacionada con COVID-19 tratados con oxígeno nasal de alto flujo: un estudio de cohorte multicéntrico Esperatti,M et al. |
Evaluar el efecto del prono vigil sobre el riesgo de IOT y mortalidad hospitalaria en pacientes con IRA relacionada con COVID-19 tratados con CNAF y analizar los efectos de diferentes tiempos de exposición al prono vigil |
Se incluyeron 335; 187 (56%) toleraron prono vigil durante [mediana (p25-75)] 12 (9-16) h/día y 148 (44%) sirvieron como controles. |
En la población de estudio, el prono vigil durante ≥ 6 h/día redujo el riesgo de IOT, y la exposición ≥ 8 h/d redujo el riesgo de mortalidad hospitalaria. |
|
El alto flujo nasal elimina el CO2 de las vías respiratorias inferiores Bräunlich J et al. |
Ilustrar el mecanismo de lavado de CO2 para que sea efectivo, incluso en la parte inferior de las vías respiratorias, mediante un modelo animal |
Pulmones de ovejas |
La CNAF redujo el CO2 en las vías respiratorias inferiores y en el espacio traqueal. Los cambios en el CO2 dependían del flujo. También hubo un aumento en la presión de las vías respiratorias en estos entornos. |
|
La oxigenoterapia con cánula nasal de alto flujo puede ser eficaz para los pacientes con insuficiencia respiratoria hipoxémica aguda con hipercapnia: un estudio retrospectivo de cohortes emparejadas por puntuación de propensión Bae SH et al. |
Investigar la efectividad de la CNAF en pacientes con IRAh y con hipercapnia en comparación con aquellos sin hipercapnia. |
862 pacientes (202 se incluyeron en el grupo hipercápnico) |
En IRAh con condiciones subyacentes, la CNAF podría ser útil para pacientes con hipercapnia. |
|
Terapia nasal de alto flujo en pacientes inmunocomprometidos con insuficiencia respiratoria aguda: revisión sistemática y metanálisis Cortegiani A et al. |
Revisión sistemática y metanálisis para abordar el papel de la CNAF en comparación con la oxigenoterapia estándar en pacientes inmunocomprometidos ingresados en UCI con IRA |
872 pacientes |
Ningún beneficio de HFNC sobre la mortalidad en pacientes inmunocomprometidos con IRA. Sin embargo, la CNAF se asoció con una tasa de intubación más baja |
|
Efecto de la oxigenoterapia con cánula nasal de alto flujo en sujetos inmunocomprometidos con insuficiencia respiratoria aguda Kang H et al. |
Metanálisis para evaluar el efecto de la CNAF en pacientes inmunocomprometidos con IRA frente a oxígeno convencional y VNI. |
2167 pacientes |
CNAF puede ser una alternativa factible a la VNI, con tasas de intubación más bajas y sin mayor riesgo de infecciones adquiridas en la UCI en comparación con el oxígeno estándar. Sin embargo, CNAF no pareció reducir la mortalidad en sujetos inmunocomprometidos con IRA en comparación con otras terapias no invasivas. |
|
El efecto de la oxigenoterapia nasal de alto flujo sobre las complicaciones pulmonares posoperatorias y la duración de la estancia hospitalaria en pacientes posoperatorios: una revisión sistemática y un metanálisis Lu y otros |
Evaluar el efecto de la CNAF sobre la duración de la estancia hospitalaria y las complicaciones pulmonares posoperatorias en pacientes posoperatorios adultos. |
2568 pacientes |
Entre los pacientes posoperatorios, la CNAF reduce significativamente la duración de la estancia hospitalaria. |
|
Cánula nasal de alto flujo en el postoperatorio inmediato: revisión sistemática y metanálisis Chaudhuri D y otros |
Evaluar los datos que examinan el uso rutinario de CNAF en el período posoperatorio inmediato. |
2201 pacientes |
La CNAF profiláctica reduce la reintubación y el aumento del soporte respiratorio en comparación con el oxígeno estándar en el período posoperatorio inmediato después de cirugía cardiotorácica. |
|
La oxigenación apneica se asocia con una reducción de la incidencia de hipoxemia durante la RSI de pacientes con hemorragia intracraneal en el servicio de urgencias Sakles JC et al. |
Evaluar la oxigenación apneica puede reducir la ocurrencia de desaturación de oxígeno durante la intubación emergente |
127 pacientes |
Los pacientes que recibieron oxigenación apneica tenían 7 veces menos probabilidades una saturación de oxígeno < 90% durante la intubación en comparación con los pacientes que no recibieron |
|
El éxito del primer paso sin hipoxemia aumenta con el uso de la oxigenación apneica durante la intubación de secuencia rápida en el departamento de emergencias Sakles JC et al. |
Determinar el efecto de la oxigenación apneica sobre el éxito del primer paso sin hipoxemia en pacientes adultos sometidos a intubación de secuencia rápida (RSI) en el servicio de urgencias |
635 pacientes |
Los resultados sugieren que el uso de la oxigenación apneica tiene el potencial de aumentar la seguridad de la RSI al reducir el número de intentos de intubación y la incidencia de hipoxemia. |
|
Predicción del éxito de la cánula nasal de alto flujo en pacientes con neumonía e insuficiencia respiratoria hipoxémica: la utilidad del índice ROX Roca J et al. |
Describir predictores tempranos y desarrollar una herramienta de predicción que identifique con precisión la necesidad de ventilación mecánica en pacientes con neumonía con IRAh tratados con CNAF |
157 pacientes |
En pacientes con IRA y neumonía, el índice ROX puede identificar pacientes con bajo riesgo de fracaso de la CNAF en los que la terapia puede continuar después de 12 horas. |
El índice ROX (calculado como [SpO2/FiO2]/FR) se utilizó para predecir el éxito de la terapia 12 h después de iniciar el tratamiento con CNAF, siendo 4,88 el valor de referencia.88 Una evaluación posterior mostró valores similares.89 Otros autores propusieron una modificación a este índice.90 Además, la inclusión de la FC mostró una asociación significativa de un valor mayor a 8,00 a las 10 h de iniciar la terapia con CNAF y un menor riesgo de fracaso.86 Se han reportado puntos de corte para este índice y diferentes tiempos de evaluación, pero hasta la fecha no hay consenso sobre el momento exacto en el que debe evaluarse.36,91,92 Se ha propuesto un índice que incluye FC y SpO2 para predecir el fracaso y el requerimiento de IOT, que mostró una mayor precisión, en pacientes con hipercapnia moderada.53 La taquipnea sostenida se ha asociado con la fatiga de los músculos respiratorios en pacientes críticos y con la necesidad de IMV y, por sí sola, es un factor asociado con la falla de la CNAF en pacientes con COVID-19.93
Debido a su medición simple y no invasiva, el índice ROX es el puntaje de predicción más estudiado y extendido; sin embargo, se deben considerar algunas limitaciones y controversias sobre el punto de corte real o cuándo debe evaluarse.6,95 Finalmente, para determinar el riesgo de intubación en pacientes con CNAF, se ha propuesto la evaluación del WOB94 y la capacidad de la puntuación HACOR, reportando una capacidad predictiva moderada.92 Ningún índice mostró superioridad sobre los demás.
Riesgos potenciales asociados al empleo de CNAF
Los pacientes con SDRA y con ventilación espontánea podrían empeorar su estado clínico y estar en riesgo de P-SILI debido al esfuerzo inspiratorio excesivo.13 Además, CNAF puede enmascarar un deterioro en la relación ventilación/perfusión y la presencia de un efecto Haldane oculto secundario al lavado de espacio muerto anatómico y reducción del CO2. Esta situación podría desencadenar una hipoxemia silenciosa y una falsa percepción de mejoría clínica. Como se postula, los pacientes pueden mostrar fatiga de los músculos respiratorios, disfunción cardíaca e insuficiencia orgánica y desencadenar peores resultados.18
Uno de los principales temores es el retraso de la intubación. Un estudio publicado recientemente mostró que la intubación tardía se asocia con una mayor mortalidad,96 mientras que otro97 mostró una tasa de mortalidad del 27,3% en pacientes con CNAF, que requirieron IMV más tarde. Finalmente, un estudio98 informó una menor mortalidad en aquellos pacientes que fueron intubados temprano en comparación con aquellos que se sometieron a IOT más tarde.
Conclusión
La CNAF se ha popularizado en los últimos años, siendo una de las principales estrategias de tratamiento de la IRAh. Los resultados reportados en otros escenarios clínicos han mostrado variaciones, según el diseño del estudio y la población, y han determinado que los pacientes deben ser cuidadosamente seleccionados. Su seguimiento, a pie de cama y no invasivo, parece sencillo pero debe interpretarse teniendo en cuenta la fisiopatología subyacente de la enfermedad. La evidencia parece apoyar que su empleo correcto puede estar asociado a una menor morbimortalidad.
Financiamiento: los autores declaran que el trabajo no tuvo financiamiento.
Conflictos de interés: los autores declaran que no tienen conflictos de intereses relacionados con el tema de esta publicación.
Contribuciones de los autores: AG: concepción y diseño original. AG, JMNS, CG, ORPN, AD: preparación del material, recolección y análisis de información. AG: primera versión del manuscrito. AG, AD, CG, EZL, ORPN, JMNS: colaboración en el resto de las versiones. AG, AD, CG, EZL, ORPN, JMNS: aprobación version final del manuscrito.
El Editor en Jefe, Dr. Carlos Luna, realizó el seguimiento del proceso de revisión y aprobó este artículo.
Referencias