RESPIRAR
REVISIÓN
https://doi.org/10.55720/respirar.14.4.7
DOI: 10.55720/respirar.14.1.2
REVISIÓN
Nutrición en fibrosis pulmonar idiopática:
el trabajo multidisciplinario como abordaje del futuro
Nutrition in Idiopathic Pulmonary Fibrosis: Multidisciplinary Work as an Approach to the Future
Verónica Inés Barcos1-2 , Juan Ignacio Enghelmayer2-3
1. Universidad Nacional de la Matanza, Buenos Aires, Argentina
2. Hospital de Clínicas "José de San Martín". División Neumonología; Universidad de Buenos Aires, Argentina
3. Fundación FUNEF. Buenos Aires, Argentina
Autor CORRESPONSAL:
Juan Ignacio Enghelmayer, juan.enghelmayer@funef.org
Recibido:
27 junio 2022
Aprobado:
16 septiembre 2022
Resumen
La fibrosis pulmonar idiopática (FPI) es la neumonía intersticial más frecuente y es una entidad en la cual hemos visto significativos avances diagnósticos y terapéuticos en los últimos años. Sin embargo, poco se ha investigado hasta ahora sobre las alteraciones nutricionales asociadas a la enfermedad. La prevalencia de malnutrición asociada a FPI ha sido estimada en alrededor de 30%, pero puede llegar hasta un 60% en pacientes en espera de trasplante de pulmón. La malnutrición es un predictor de riesgo independiente de mortalidad en los pacientes con FPI, y muchas veces se manifiesta a través de la variación de peso y/o cambios en la composición corporal, lo que puede conducir a un deterioro de la masa muscular y/o ósea. El origen de la malnutrición en la FPI es multifactorial y no del todo conocido. Algunos pacientes con FPI avanzada, aun teniendo un peso corporal preservado, suelen tener una pérdida de la masa magra, lo cual se asocia a disfunción muscular y bajo rendimiento físico. La debilidad muscular resultante lleva a desacondicionamiento físico y mayor disnea, reducción de la tolerancia al ejercicio y deterioro de la calidad de vida. Es por ello que, para mejorar el abordaje de la FPI, se deberá incorporar al nutricionista en el equipo multidisciplinario con el objetivo de realizar un diagnóstico precoz del estado nutricional, lo que permitirá identificar alteraciones tempranas y realizar la intervención nutricional adecuada.
Palabras clave: fibrosis pulmonar idiopática, nutrición, sarcopenia.
Abstract
Idiopathic pulmonary fibrosis (IPF) is the most common interstitial pneumonia and has undergone significant diagnostic and therapeutic advances in recent years. However, little has been investigated so far regarding the nutritional alterations associated with the disease. The prevalence of malnutrition associated with IPF has been estimated around 30%, but it can reach up to 60% in patients awaiting lung transplantation. Malnutrition is an independent predictor of mortality in patients with IPF, and often manifests through weight reduction and/or changes in body composition, which can lead to a deterioration in muscle and/or bone mass. The origin of malnutrition in IPF is multifactorial and not entirely known. Some patients with advanced IPF, even having a preserved body weight, tend to have a loss of lean mass, which is associated with muscle dysfunction and poor physical performance. The resulting muscle weakness leads to physical deconditioning and greater dyspnea, reduced exercise tolerance and deterioration in quality of life. Consequently, in order to improve the approach to IPF, the nutritionist should be incorporated into the multidisciplinary team with the aim of making an early diagnosis of nutritional status, which will allow the identification of early alterations and the appropriate nutritional intervention.
Keywords: idiopathic pulmonary fibrosis, nutrition, sarcopenia.
La fibrosis pulmonar idiopática (FPI) se describe como una neumonía intersticial fibrosante limitada al pulmón y con un pronóstico frecuentemente desfavorable. Su causa es desconocida y a pesar de ser la enfermedad pulmonar intersticial (EPI) más frecuente, continúa teniendo una reducida sobrevida aun habiendo significativos avances terapéuticos surgidos en la última década.1 Durante estos últimos años se ha producido un punto de inflexión en el manejo de esta entidad, con la conformación de centros de referencia en EPI que trabajan de manera multidisciplinaria para lograr un mejor abordaje de estos pacientes.
Si bien el progreso en el enfoque diagnóstico de las EPI sumado al desarrollo de nuevas terapias antifibróticas ha sido elocuente, y ha logrado un diagnóstico más preciso y un enlentecimiento en la velocidad de progresión de la enfermedad,2 también debemos reconocer que los avances en el conocimiento de las comorbilidades y las manifestaciones sistémicas de la FPI siguen un ritmo más lento.3
Desde hace tiempo conocemos el impacto de la desnutrición en algunas enfermedades respiratorias crónicas como la enfermedad pulmonar obstructiva crónica (EPOC) y la fibrosis quística. En estas entidades, sobre todo en el contexto de enfermedad avanzada, es reconocido que la disnea severa, a veces asociada a síntomas como reflujo gastroesofágico y/o dificultades deglutorias y pérdida de apetito, son causa de una ingesta insuficiente de nutrientes. A esto se le suma la alta demanda metabólica, lo que lleva a una conducta constante que conduce a la desnutrición.4 En estos pacientes, la mera actividad de alimentarse muchas veces les representa un esfuerzo difícil de realizar. Una situación parecida, con merma de la ingesta oral y el aumento de las necesidades energéticas, también es frecuente en la FPI.
La desnutrición es “un estado resultante de la falta de ingesta o absorción de nutrientes que conduce a la alteración de la composición corporal (disminución de la masa libre de grasa) y la masa celular corporal que conduce a una disminución de la función física y mental y a un resultado clínico deteriorado de la enfermedad”. Este cuadro puede deberse a distintas causas, entre ellas la inanición, la enfermedad crónica o el envejecimiento avanzado, o a una combinación de las anteriores.5
Un bajo índice de masa corporal (IMC), o bajo Índice de Masa Libre de Grasa (IMLG), es un parámetro asociado a la desnutrición en el contexto clínico diario y, además, un predictor de riesgo independiente de mortalidad en los pacientes con EPOC y FPI.6 –11 A pesar de ser una medida muy reconocida a nivel mundial, el IMC resulta un parámetro poco sensible para detectar de manera precoz la malnutrición y alteraciones en el IMLG.12,13
Los trastornos del estado nutricional son una de las comorbilidades más comunes asociadas a la FPI, y suelen manifestarse a través de la variación de peso y/o cambios en la composición corporal. Esto puede conducir a un deterioro de la masa muscular y/o ósea.14
Existen diferentes métodos para evaluar la composición corporal: el análisis de impedancia bioeléctrica (BIE) es el parámetro más simple y preciso,15,16 aunque su uso no se encuentra todavía muy difundido en nuestra práctica clínica. Asimismo, los métodos de diagnóstico por imágenes (ecografía, resonancia magnética y tomografía computada) son herramientas que actualmente se están usando de manera creciente para medir la composición corporal, y muestran un futuro promisorio.
La prevalencia de malnutrición asociada a FPI es alta, desde un 23%,9 hasta más del 30% de pacientes con FPI con requerimientos de oxigenoterapia.17
Un trabajo más reciente, en una cohorte de pacientes con enfermedad menos severa, también encontró que el 28% tenía un bajo IMLG medido por BIE.6 Estos mismos autores encontraron que el IMC y la circunferencia del brazo se asocian de manera independiente con un bajo IMLG. Por otra parte, en una nueva investigación italiana con 90 individuos con FPI se encontró que un 67,8% de los pacientes tenían un estado nutrición normal, seguido de un 25% de obesos no sarcopénicos, un 4,6% de sarcopénicos y un 2.3% de obesos sarcopénicos. Sin embargo, entre los normonutridos, el 49,2% mostró signos tempranos de alteraciones nutricionales y del rendimiento físico, incluido IMC ≥ 30 en 4,3%, antecedentes de pérdida de peso ≥ 5% en 11,9% y reducción de la fuerza de prensión manual medida con un dinamómetro, en 35,6% de los pacientes. Además, se observaron valores bajos de vitamina D en el 56,3% de los casos. Los autores concluyeron que los pacientes con FPI en el momento del diagnóstico suelen tener una nutrición normal y son obesos, pero en esta etapa ya se pueden identificar signos tempranos de deterioro nutricional.18
Cabe señalar que las cifras de malnutrición llegan hasta el 60% en pacientes con FPI candidatos a trasplante de pulmón.19 A su vez, existen diferencias étnicas. Un estudio japonés reportó que no solo la presencia de un bajo valor de IMC, sino también sus cambios en tiempo, se asocian con mayor mortalidad en FPI.10 Otro estudio reciente que utilizó una cohorte japonesa de derivación y otra inglesa de validación obtuvo los mismos resultados.20 Además, los descensos en el IMC se asociaron con mayor mortalidad de manera independiente de la caída de la capacidad vital forzada (FVC) y del nivel basal de IMC. Pero si hablamos de IMC y pérdida de peso en el tiempo en enfermos con FPI, uno de los trabajos más contundentes al respecto es el recientemente publicado por Jouneau y cols.21 Este grupo de investigadores realizó un análisis post hoc de los pacientes que recibieron placebo en los estudios ASCEND, CAPACITY y de todos los pacientes en el estudio INSPIRE. Los pacientes que ingresaron a los ensayos clínicos con un IMC basal < 25 kg/m2 o que tuvieron una pérdida de peso anualizada de > 5% tuvieron mayor pérdida de FVC, incremento de las hospitalizaciones y mayor riesgo de muerte que aquellos con un IMC inicial ≥ 25 kg/m2 o sin pérdida de peso.
Estos hallazgos son categóricos y nos hacen suponer que la pérdida de peso en algunos pacientes con FPI podría reflejar otros aspectos de la progresión de la enfermedad que la FVC no puede detectar.20
Tener un peso corporal conservado no es un elemento clínico confiable en algunos casos de FPI avanzada, dado que muchos de estos pacientes suelen tener una pérdida de más del 60% de la masa magra,19 lo cual se asocia muchas veces a disfunción muscular y bajo rendimiento físico,22,23 y pone en evidencia una vez más la limitada utilidad del IMC para la evaluación de los casos severos de FPI.
Esta aparente paradoja de peso corporal normal con pérdida de masa magra se relaciona con un aumento del porcentaje relativo de tejido graso, aunque también existen pacientes con pérdida combinada de peso corporal y masa magra.23–25
A la hora de realizar la valoración del estado nutricional, no debemos olvidar que tanto la pérdida de peso corporal como de masa magra son indicadores de mal pronóstico en la FPI,9,19 por lo que su evaluación precoz resulta fundamental para un correcto abordaje multidisciplinario de la enfermedad. En este sentido, para una mejor valoración de la composición corporal, quizás pueda ayudarnos en el futuro la tomografía computada de tórax de alta resolución (TCAR), técnica de uso rutinario para el diagnóstico y seguimiento de los pacientes con EPI. Las imágenes de TCAR a nivel vertebral lumbar (L3) se correlacionan significativamente con la cantidad y calidad del músculo corporal total confirmando el diagnóstico de sarcopenia. Además, la TCAR junto a la resonancia magnética se consideran el gold estándar para el diagnóstico de sarcopenia.23 En un estudio piloto, Jalaber y cols. encontraron que la cuantificación de la masa muscular por TCAR medida a nivel de la primera vértebra lumbar tenía correlación con el estado nutricional de los pacientes, con una sensibilidad de 79%, una especificidad 69% para el diagnóstico de desnutrición.26
La pérdida de masa magra tiene como resultado la debilidad muscular que impacta tanto en los músculos respiratorios como periféricos.27–29 Esta condición clínica trae aparejada una reducción de la tolerancia al ejercicio y empeoramiento de la calidad de vida.25,30 En una reciente investigación en Australia, en una cohorte con más de 90 pacientes con enfermedad intersticial de los cuales 30% tenían FPI, la fuerza de agarre de la mano, medida mediante un dinamómetro, se encontró reducida, hecho que se asoció con un deterioro de la calidad de vida.31
En los últimos años han aumentado las publicaciones de estudios que intentan acercarnos a la realidad nutricional de los enfermos con FPI y su impacto en la sobrevida, sin embargo, aún es escaso lo que se sabe sobre sus causas y, como está descrito en otras enfermedades crónicas, probablemente el origen de la desnutrición y la disfunción muscular en las EPI sea multifactorial.
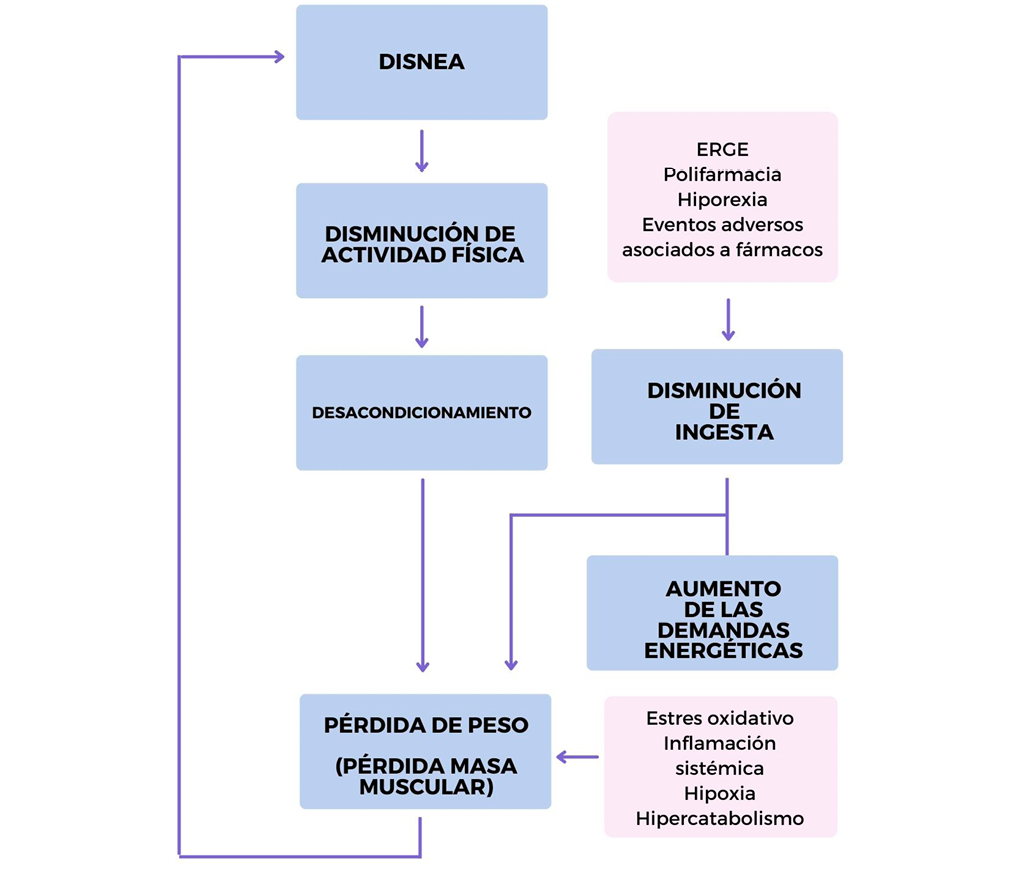
La reducción progresiva del nivel de actividad física, consecuencia de la disnea, produce un desacondicionamiento de los distintos sistemas, incluyendo al aparato cardiovascular y músculo-esquelético, lo que motiva el círculo vicioso de disnea-inactividad y desacondicionamiento orgánico. Cabe destacar que los pacientes con FPI pueden presentar inconvenientes para alimentarse como consecuencia de la disnea severa. Sin embargo, hay otras posibles etiologías, incluyendo a la hiporexia como evento adverso relacionado con el tratamiento farmacológico y a un aumento del estrés oxidativo y de la actividad inflamatoria a nivel pulmonar y sistémico que, junto a la hipoxia tisular, son capaces de inducir tanto una depleción de la síntesis proteica como un aumento del catabolismo.32,33
Asimismo, la FPI suele manifestarse después de los 50 años, momento en el cual la pérdida fisiológica de masa y función muscular (identificada como sarcopenia primaria) es característica de estos pacientes, agregándose a los elementos previamente mencionados.34 Finalmente, los tratamientos disponibles para la FPI también pueden tener un impacto negativo. Los esteroides sistémicos,35 reservados sólo para las exacerbaciones agudas de la enfermedad, pueden producir alteraciones nutricionales a través de la reducción de la síntesis proteica y un incremento en su degradación,36,37 así como inducir miopatía esteroidea y conducir a la debilidad muscular. Los antifibróticos, el nintedanib y la pirfenidona, por su parte, pueden ocasionar pérdida de peso y de masa magra, debido a la anorexia y otros eventos adversos gastrointestinales.38 Figura 1.
Hasta el día de hoy, la evaluación del estado nutricional y su correcto abordaje en el paciente con EPI son temas recientemente explorados y que se debe continuar investigando. Las guías basadas en la evidencia para el diagnóstico y tratamiento de la FPI actualizadas en 2022 no han hecho referencia a recomendaciones específicas en relación con los aspectos nutricionales.39 Resultaría de gran utilidad considerar directrices nutricionales sobre evaluación y recomendaciones en futuras actualizaciones de las mismas.
Con vistas al futuro, es fundamental para el abordaje integral de las EPI considerar al licenciado en nutrición dentro del equipo multidisciplinario, con el objetivo de incluir en la evaluación inicial, un diagnóstico precoz del estado nutricional, identificar alteraciones tempranas y realizar la intervención nutricional adecuada.40 Así como también, aun existiendo el buen estado nutricional, apuntar a la prevención de la malnutrición. Determinar la existencia de sarcopenia es un componente útil de la evaluación de la fragilidad y un predictor de supervivencia en esta población de pacientes. Otros aspectos relevantes son la optimización del estado nutricional, la evaluación del uso de suplementos nutricionales, la indicación de la actividad física aeróbica y los ejercicios de fuerza muscular, prescindir de un uso inadecuado de corticosteroides sistémicos, retardar el avance de la enfermedad, ocuparse prontamente del tratamiento de la hipoxemia, prevenir y tratar las exacerbaciones que pueden tener un efecto negativo sobre la inflamación sistémica.14 Además, es de crucial importancia la derivación de los pacientes a programas de rehabilitación (entrenamiento general y muscular) porque han demostrado ser beneficiosos para la función muscular y la mejoría de la calidad de vida.28,41,42
Conclusión
Las deficiencias nutricionales y/o la afección de la composición corporal son frecuentes en los pacientes con EPI y, dado su impacto pronóstico, deberán ser identificadas y abordadas de manera precoz, lo cual requiere la conformación de un equipo multidisciplinario. Sólo de esta manera lograremos un abordaje más integral y adecuado para mejorar la calidad de vida de nuestros pacientes.
Financiamiento: los autores declaran que el trabajo no tuvo financiamiento.
Conflictos de interés: VB: declara haber recibido honorarios por disertaciones en conferencias de los laboratorios Boehringer Ingelheim, Raffo, Asofarma y Grupo Biotoscanat Knight. JIE: declara haber recibido honorarios por consultorías, disertaciones en conferencias, asesoramiento científico y por proyectos académicos de las compañías Boehringer Ingelheim, Bristol Myers, Roche, Raffo, Asofarma, Bagó, Tuteur, Grupo Biotoscanat Knight, Finadiet y Everex.
Contribuciones de los autores: los autores contribuyeron de manera equivalente en la idea, desarrollo, redacción y escritura del manuscrito. VB realizó la figura.
Los Editores en Jefe, Dres. Carlos Luna y Francisco Arancibia, aprobaron este artículo.
Referencias
1. Raghu G, Remy-Jardin M, Richeldi L
2. Sgalla G, Iovene B, Calvello M, Ori M, Varone F, Richeldi L. Idiopathic pulmonary fibrosis: pathogenesis and management. Respir Res 2018;19(1):32. http://dx.doi.org/10.1186/s12931-018-0730-2
3. Man L, Hong P. Idiopathic Pulmonary Fibrosis: A Systemic Disease? Chin Med J 2017;130(17):2140–1.
4. Nordén J, Grönberg AM, Bosaeus I et al. Nutrition impact symptoms and body composition in patients with COPD. Eur J Clin Nutr 2015;69(2):256–61.
5. Cederholm T, Barazzoni R, Austin P et al. ESPEN guidelines on definitions and terminology of clinical nutrition. Clin Nutr 2017;36(1):49–64.
6. Jouneau S, Kerjouan M, Rousseau C et al. What are the best indicators to assess malnutrition in idiopathic pulmonary fibrosis patients? A cross-sectional study in a referral center. Nutrition 2019;62:115–21.
7. Schols AMWJ, Broekhuizen R, Weling-Scheepers CA, Wouters EF. Body composition and mortality in chronic obstructive pulmonary disease. Am J Clin Nutr 2005;82(1):53–9.
8. Vestbo J, Prescott E, Almdal T et al. Body mass, fat-free body mass, and prognosis in patients with chronic obstructive pulmonary disease from a random population sample: findings from the Copenhagen City Heart Study. Am J Respir Crit Care Med 2006;173(1):79–83.
9. Alakhras M, Decker PA, Nadrous HF, Collazo-Clavell M, Ryu JH. Body mass index and mortality in patients with idiopathic pulmonary fibrosis. Chest 2007;131(5):1448–53.
10. Kishaba T, Nagano H, Nei Y, Yamashiro S. Body mass index-percent forced vital capacity-respiratory hospitalization: new staging for idiopathic pulmonary fibrosis patients. J Thorac Dis 2016;8(12):3596–604.
11. Nishiyama O, Yamazaki R, Sano H et al. Fat-free mass index predicts survival in patients with idiopathic pulmonary fibrosis. Respirology 2017;22(3):480–5.
12. Thibault R, Le Gallic E, Picard-Kossovsky M, Darmaun D, Chambellan A. Assessment of nutritional status and body composition in patients with COPD: comparison of several methods. Rev Mal Respir 2010;27(7):693–702.
13. Almeida JMG, García CG, Castañeda VB, Guerrero DB. Nuevo enfoque de la nutrición. Valoración del estado nutricional del paciente: función y composición corporal
14. Gea J, Badenes D, Balcells E. Nutritional status in patients with Idiopathic Pulmonary Fibrosis. Pulm Crit Care Med 2018;3(1).
15. Kyle UG, Bosaeus I, De Lorenzo AD et al. Bioelectrical impedance analysis-part II: utilization in clinical practice. Clin Nutr 2004;23(6):1430–53.
16. Thibault R, Genton L, Pichard C. Body composition: why, when and for who? Clin Nutr 2012;31(4):435–47.
17. Chailleux E, Fauroux B, Binet F, Dautzenberg B, Polu JM. Predictors of survival in patients receiving domiciliary oxygen therapy or mechanical ventilation. A 10-year analysis of ANTADIR Observatory. Chest 1996;109(3):741–9.
18. Faverio P, Fumagalli A, Conti S et al. Nutritional assessment in idiopathic pulmonary fibrosis: a prospective multicentre study. ERJ Open Res 2022;8(1).
19. Schwebel C, Pin I, Barnoud D et al. Prevalence and consequences of nutritional depletion in lung transplant candidates. Eur Respir J 2000;16(6):1050–5.
20. Nakatsuka Y, Handa T, Kokosi M et al. The Clinical Significance of Body Weight Loss in Idiopathic Pulmonary Fibrosis Patients. Respiration 2018;96(4):338–47.
21. Jouneau S, Crestani B, Thibault R et al. Post hoc Analysis of Clinical Outcomes in Placebo- and Pirfenidone-Treated Patients with IPF Stratified by BMI and Weight Loss. Respiration 2022;101(2):142–54.
22. Gea J, Sancho-Muñoz A, Chalela R. Nutritional status and muscle dysfunction in chronic respiratory diseases: stable phase versus acute exacerbations. J Thorac Dis 2018;10(Suppl 12):S1332–54.
23. Cruz-Jentoft AJ, Bahat G, Bauer J et al. Sarcopenia: revised European consensus on definition and diagnosis. Age Ageing 2019;48(1):16–31.
24. Gea J, Bàdenes D, Balcells E. Nutritional Abnormalities And Muscle Dysfunction In Idiopathic Pulmonary Fibrosis. Arch Bronconeumol 2018;54(11):545–6.
25. Madill J, Maurer JR, de Hoyos A. A comparison of preoperative and postoperative nutritional states of lung transplant recipients. Transplantation 1993;56(2):347–50.
26. Jalaber C, Lemerre-Poincloux J, Jouneau S et al. Usefulness of Body Composition CT Analysis in Patients with Idiopathic Pulmonary Fibrosis: A Pilot Study. Acad Radiol 2022;29 Suppl 2:S191–201.
27. Kozu R, Jenkins S, Senjyu H. Evaluation of activity limitation in patients with idiopathic pulmonary fibrosis grouped according to Medical Research Council dyspnea grade. Arch Phys Med Rehabil 2014;95(5):950–5.
28. Jackson RM, Gómez-Marín OW, Ramos CF et al. Exercise limitation in IPF patients: a randomized trial of pulmonary rehabilitation. Lung 2014;192(3):367–76.
29. Nishiyama O, Taniguchi H, Kondoh Y et al. Quadriceps weakness is related to exercise capacity in idiopathic pulmonary fibrosis. Chest 2005;127(6):2028–33.
30. van Manen MJG, Geelhoed JJM, Tak NC, Wijsenbeek MS. Optimizing quality of life in patients with idiopathic pulmonary fibrosis. Ther Adv Respir Dis 2017;11(3):157–69.
31. Kanjrawi AA, Mathers L, Webster S, Corte TJ, Carey S. Nutritional status and quality of life in interstitial lung disease: a prospective cohort study. BMC Pulm Med 2021;21(1):51.
32. Argilés JM, Busquets S, Stemmler B, López-Soriano FJ. Cachexia and sarcopenia: mechanisms and potential targets for intervention. Curr Opin Pharmacol 2015;22:100–6.
33. Bunn HF, Poyton RO. Oxygen sensing and molecular adaptation to hypoxia. Physiol Rev 1996;76(3):839–85.
35. Idiopathic Pulmonary Fibrosis Clinical Research Network, Raghu G, Anstrom KJ, King TE Jr, Lasky JA, Martinez FJ. Prednisone, azathioprine, and N-acetylcysteine for pulmonary fibrosis. N Engl J Med 2012;366(21):1968–77.
36. Hasselgren PO, Alamdari N, Aversa Z, Gonnella P, Smith IJ, Tizio S. Corticosteroids and muscle wasting: role of transcription factors, nuclear cofactors, and hyperacetylation. Curr Opin Clin Nutr Metab Care 2010;13(4):423–8.
37. Schakman O, Gilson H, Kalista S, Thissen JP. Mechanisms of muscle atrophy induced by glucocorticoids. Horm Res 2009;72 Suppl 1:36–41.
38. Rogliani P, Calzetta L, Cavalli F, Matera MG, Cazzola M. Pirfenidone, nintedanib and N-acetylcysteine for the treatment of idiopathic pulmonary fibrosis: A systematic review and meta-analysis. Pulm Pharmacol Ther 2016;40:95–103.
39. Raghu G, Remy-Jardin M, Myers JL et al. Diagnosis of Idiopathic Pulmonary Fibrosis. An Official ATS/ERS/JRS/ALAT Clinical Practice Guideline. Am J Respir Crit Care Med 2018;198(5):e44–68.
40. Barbosa-Silva MCG, Barros AJD. Indications and limitations of the use of subjective global assessment in clinical practice: an update. Curr Opin Clin Nutr Metab Care 2006;9(3):263–9.
41. Kozu R, Senjyu H, Jenkins SC, Mukae H, Sakamoto N, Kohno S. Differences in response to pulmonary rehabilitation in idiopathic pulmonary fibrosis and chronic obstructive pulmonary disease. Respiration 2011;81(3):196–205.
42. Barcos VI, Enghelmayer JI. Nutrición en fibrosis pulmonar idiopática: ¿La gran olvidada? [Nutrition in idiopathic pulmonary fibrosis: The great forgotten?]. Medicina (B Aires) 2021;81(4):671-673.
Esta revista está bajo una licencia de
Creative Commons Reconocimiento 4.0 Internacional.
Figura 1.
El mecanismo de la desnutrición en la FPI